
| A. | 放电时正极附近溶液的碱性增强 | |
| B. | 充电时锌极与外电源正极相连 | |
| C. | 放电时每转移3 mol电子,正极有1mol K2FeO4被还原 | |
| D. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO42-+4 H2O |
分析 根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,高铁酸钠在正极得到电子,电极反应式为FeO42+4H2O+3e-=Fe(OH)3+5OH-,根据电极反应式可判断电子转移的物质的量与反应物之间的关系,充电时,阳极上氢氧化铁转化成高铁酸钠,电极反应式为Fe(OH)3+5OH-=FeO42+4H2O+3e-,阳极消耗OH-离子,碱性要减弱.
解答 解:A.放电时正极附近有OH-生成,所以正极附近碱性增强,故A正确;
B.充电时锌极与外电源负极相连,故B错误;
C.放电时正极转化为:FeO42-→Fe(OH)3,1mol K2FeO4被还原要得到3mol电子,故C正确;
D.充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O,该电池环境为碱性环境,故D正确;
故选B.
点评 本题考查可充电电池,放电为原电池,充电为电解池,要注意电池内部环境的酸碱性.


科目:高中化学 来源: 题型:选择题
| A. | “地沟油”是指从泔水中提取的油脂,它也是一种资源,但不能食用,可用于生产燃料油或用于制肥皂 | |
| B. | 媒体曝光的制造问题胶囊的工业明胶的主要成分是蛋白质 | |
| C. | 塑化剂DEHP是邻苯二甲酸(2─乙基己基)二酯,对人体无害可用作食品添加剂 | |
| D. | PM2.5是指大气中直径≤2.5×10-6m的颗粒物(气溶胶),可通过加水吸收后再用半透膜渗析的方法分离PM2.5微粒与可溶性吸附物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验装置 | 现象 |
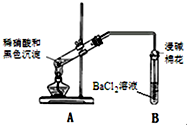 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
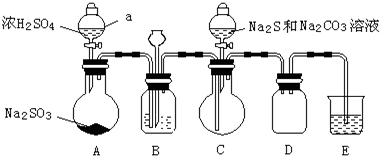
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S、Na2CO3 Na2SO4 及 Na2SO3 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3, 一定不含有Na2S、Na2SO4. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol的CaO2含阴阳离子总数是0.3NA | |
| B. | 0.1 mol苯乙烯含π键的数目为0.4NA | |
| C. | 1 L 1mol/L的Na2CO3溶液中含阴阳离子数小于3NA | |
| D. | 2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
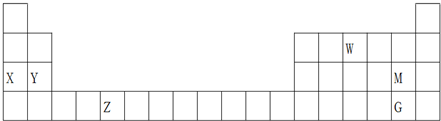
| A. | 最高价氧化物的水化物的碱性:X<Y | |
| B. | W的氢化物的球棍模型为: | |
| C. | 酸性:HMO4<HGO4 | |
| D. | Z的某些化合物可以用作反应的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
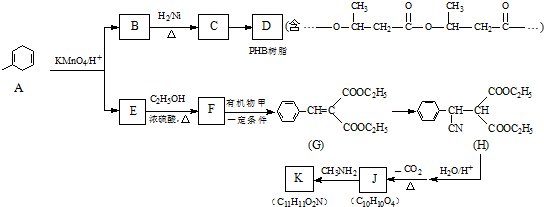
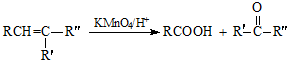
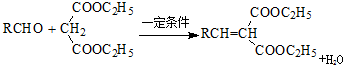
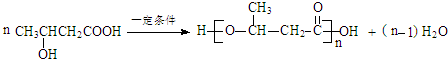 :.
:. .
.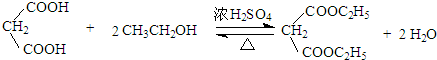 .
.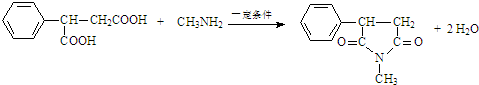 .
.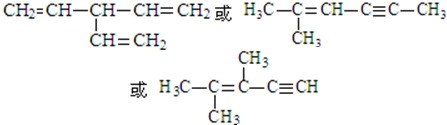 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100g•mol-1 | B. | 108g•mol-1 | C. | 55g•mol-1 | D. | 96g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
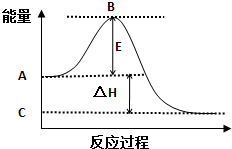 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com