
| A. | ①② | B. | ①③ | C. | ③④ | D. | ②④ |
分析 醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,醋酸浓度越大,其电离程度越小,要使CH3COOH的电离程度增大,则应该使醋酸的浓度减小,据此结合影响弱电解质的电离平衡的因素进行判断.
解答 解:①加少量CH3COONa固体,醋酸根离子浓度增大,电离平衡性质逆向移动,则醋酸的电离程度减小,故①错误;
②弱电解质的电离过程为吸热反应,升高温度,电离平衡向着正向移动,则醋酸的电离程度增大,故②正确;
③加少量冰醋酸,醋酸的浓度增大,则醋酸的电离程度减小,故③错误;
④加水,醋酸浓度减小,则醋酸的电离程度增大,故④正确;
故选D.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度不大,明确影响弱电解质的电离平衡的因素为解答关键,注意弱电解质的电离为吸热过程,试题培养了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
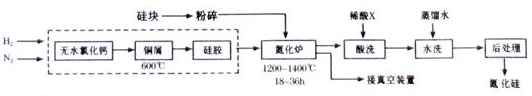
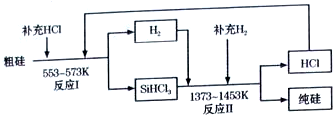
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=+890kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=890kJ•mol-1 | |
| D. | $\frac{1}{2}$ CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-445kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 结论 | |
| A | HClO与H2SO3反应生成H2SO4和HCl | 非金属性:Cl>S |
| B | N2比白磷稳定得多 | 非金属性:P>N |
| C | 在约800℃时,金属钠可从熔融的KCl中置换出K | 金属性:Na>K |
| D | 工业上电解Na2AlF6和Al2O3的熔融混合物得到Al | 金属活动性:Na>Al |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 运用碳及其化合物的性质,完成下列小题:
运用碳及其化合物的性质,完成下列小题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 甲烷的标准燃烧热△H=-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-═2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸中:K+、MnO4-、CH3CH2OH | |
| B. | pH=11的溶液中:Na+、CO32-、NH3•H2O | |
| C. | 中性溶液中:Na+、NO3-、AlO2- | |
| D. | FeCl3溶液中:H2O2、Mg2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com