
分析 BaCl2溶液和AgNO3溶液混合发生反应Ag++Cl-=AgCl↓,根据c=$\frac{n}{V}$计算混合溶液中Cl-浓度,再据Ksp(AgCl)=1.8×10-10计算Ag+的浓度.
解答 解:BaCl2溶液和AgNO3溶液混合发生反应Ag++Cl-=AgCl↓,反应后溶液中Cl-的物质的量浓度为$\frac{0.01mol/L×2×0.01L-0.01mol/L×0.01L}{0.02L}$=0.005mol/L,Ksp(AgCl)=1.8×10-10,所以Ag+的浓度为$\frac{1.8×1{0}^{-10}}{5×1{0}^{-3}}$=3.6×10-8 mol/L,
故答案为:3.6×10-8 mol/L.
点评 本题考查物质的量浓度有关计算、据沉淀的溶度积的有关计算等,比较基础,关键是根据离子方程式确定氯离子的物质的量.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:推断题
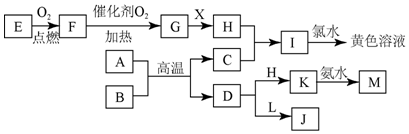
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2和HCl | B. | NaOH和NaHCO3 | C. | CO2和NaOH | D. | Na2CO3和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 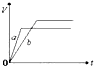 | B. |  | C. | 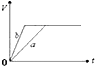 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cs显+3价 | |
| B. | CsICl2溶于水,电离生成:Cs+、I-、Cl- | |
| C. | 酸性高锰酸钾溶液中滴加CsICl2溶液,溶液褪色 | |
| D. | 在CsICl2溶液中通入Cl2,有单质碘生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 中和热测定实验中,若用铜质搅拌器,则所测中和热的绝对值偏大 | |
| C. | 利用油脂在碱性条件下的水解,可以制甘油和肥皂 | |
| D. | 蛋白质属于天然高分子化合物,盐酸可以使蛋白质变黄,称为颜色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com