
 ��g��
��g��| Pt-Sn/Al2O3 |
| ���� |
 ��g��+3H2��g��
��g��+3H2��g��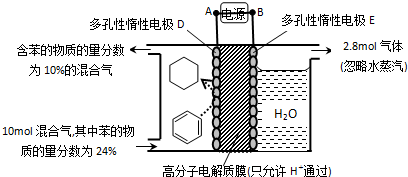
| ����Ŀ��������ĵĵ����� |
| ת�Ƶĵ������� |
| c(C6H6)��c3(H2) |
| c(C6H12) |
| c(C6H6)?c3(H2) |
| c(C6H12) |
| b��(3b)3 |
| (a-b) |
| 27b4 |
| a-b |
| 27b4 |
| a-b |
| 10mol��24%-x |
| 10mol-3xmol+5.6mol |
| 7.2mol |
| 11.2mol |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.1mol?L-1 CH3COONa��Һ��0.1mol?L-1 HCl��Һ�������ϣ�c��Na+��=c��Cl-����c��CH3COO-����c��OH-�� | ||
| B��0.1mol?L-1 NH4Cl��Һ��0.1mol?L-1��ˮ�������ϣ�pH��7����c��NH3?H2O����c��NH4+����c��Cl-����c��OH-�� | ||
C��0.1mol?L-1 Na2CO3��Һ��0.1mol?L-1 NaHCO3��Һ�������ϣ�
| ||
| D��0.1mol?L-1 Na2C2O4��Һ��0.1mol?L-1 HCl��Һ�������ϣ�H2C2O4Ϊ��Ԫ���ᣩ��2c��C2O42-��+c��HC2O4-��+c��OH-��=c��Na+��+c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| O | - 4 |
| O | - 4 |
| A��+1 | B��+2 | C��+3 | D��+4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
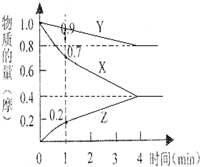 ��1��ij�¶�ʱ��2L���ܱ�������X��Y��Z�������ʵ����ʵ�����ʱ��ı仯��ͼ��ʾ����ͼ�����ݷ������÷�Ӧ�Ļ�ѧ����ʽΪ
��1��ij�¶�ʱ��2L���ܱ�������X��Y��Z�������ʵ����ʵ�����ʱ��ı仯��ͼ��ʾ����ͼ�����ݷ������÷�Ӧ�Ļ�ѧ����ʽΪ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | NaCl | KCl | CaO |
| ������/��kJ?mol-1�� | 786 | 715 | 3401 |
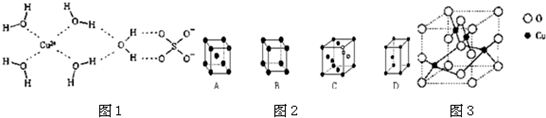
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
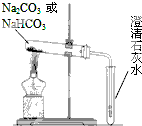 ̼���ƣ�Na2CO3����̼�����ƣ�NaHCO3��������Ϊʳ�ü
̼���ƣ�Na2CO3����̼�����ƣ�NaHCO3��������Ϊʳ�ü�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ijЩ�Ͼ����Ͽɲ������з����������������ϸ���������ǿ�ȣ�ʹ�������õ����ʣ�ʵ��װ����ͼ������ij�����ϵõ��IJ��������
ijЩ�Ͼ����Ͽɲ������з����������������ϸ���������ǿ�ȣ�ʹ�������õ����ʣ�ʵ��װ����ͼ������ij�����ϵõ��IJ��������| ���� | ���� | ���� | ��ϩ | ��ϩ | �� | �ױ� | ̼ |
| ����������%�� | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
| �� |
| �� |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
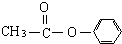 ��
��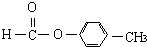 ������֣���ֱ�д���ṹ��ʽ��
������֣���ֱ�д���ṹ��ʽ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��pH=1��NaHSO4��Һ��c��H+��=c��SO42-��+c��OH-�� |
| B������AgCl��AgI���������Һ��c��Ag+����c��Cl-��=c��I-�� |
| C��CO2��ˮ��Һ��c��H+����c��HCO3-��=2c��CO32-�� |
| D���������ʵ���NaHC2O4��Na2C2O4����Һ��3c��Na+��=2[c��HC2O4-��+c��C2O42-��+c��H2C2O4��] |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com