
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液;X、Y都是惰性电极,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液;X、Y都是惰性电极,通过导线与直流电源相连.请回答以下问题:科目:高中化学 来源: 题型:选择题
| A. | H2在正极发生氧化反应 | |
| B. | 供电时的总反应为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| C. | 氢氧燃料电池中H2和O2燃烧放出的热量转变为电能 | |
| D. | 氢氧燃料电池产物是水,属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.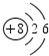 若一个B原子中有8个中子,写出B的原子符号168O.
若一个B原子中有8个中子,写出B的原子符号168O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO | B. | O2 | C. | NO2和O2 | D. | NO和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 只有非金属原子间才能形成共价键 | |
| C. | 由共价键形成的一定是共价化合物分子 | |
| D. | 熔化后不导电的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com