
用NA表示阿伏加德罗常数的数值,下列说法正确的是()
A. 标准状况下,22.4LCCl4含有NA个分子
标准状况下,22.4LCCl4含有NA个分子
B. 0.1molAlCl3完全转化为胶体,生成胶体粒子的数目为0.l NA个
C. 常温常压下46gNO2和N2O4的混合气体含有3NA个原子
D. 0.1molCl2与足量冷的NaOH溶液反应,转移电子数为0.2 NA
考点: 阿伏加德罗常数.
专题: 阿伏加德罗常数和阿伏加德罗定律.
分析: A、标况下,是CCl4是液态;
B、一个Al(OH)3胶粒是多个Al(OH)3的集合体;
C、根据NO2和N2O4的最简式均为NO2来计算;
D、Cl2与NaOH的反应为歧化反应来分析.
解答: 解:A、标况下,是CCl4是液态,故A错误;
B、一个Al(OH)3胶粒是多个Al(OH)3的集合体,故生成胶体粒子的数目少于0.l NA个,故B错误;
C、NO2和N2O4的最简式均为NO2,故46g混合气体中NO2的物质的量n=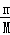 =
=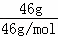 =1mol,而1molNO2中含3mol原子,故含有的原子个数为3NA个,故C正确;
=1mol,而1molNO2中含3mol原子,故含有的原子个数为3NA个,故C正确;
D、Cl2与NaOH的反应为歧化反应:Cl2+2NaOH=NaCl+NaClO+H2O,此反应中1molCl2转移1mol电子,故0.1mol氯气转移0.1mol电子,故D错误.
故选C.
点评: 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:
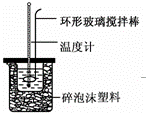
实验室用50mL 0.50mol•L﹣1盐酸、50mL 0.55mol•L﹣1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 起始温度t1/℃ 终止温度t2/℃
盐酸 NaOH溶液
1 20.2 20.3 23.7
2 20.3 20.5 23 .8
.8
3 21.5 21.6 24.9
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 .
(2)在操作正确的前提下,提高中和热测定准确性的关键是: .
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H= .如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将 (填“偏大”、“偏小”、“不变”).
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温 较高
较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
查看答案和解析>>
科目:高中化学 来源: 题型:
日常生活中很多问题涉及到化学知识.下列叙述正确的是()
A. 用食醋清洗热水瓶中的水垢;用米汤检验碘盐中含有碘酸钾
B. 用小苏打可中和胃酸,热纯碱溶液可除油污.小苏打和纯碱可以用石灰水鉴别
C. “84消毒液”和洁厕剂能同时使用,除污垢效果好
D. 用丁达尔效应区别鸡蛋白溶液和食盐水;用明矾可以净水
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:
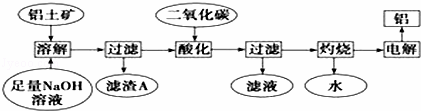
已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的Na2SiO3与Na2与 反应,能生成硅铝酸盐沉淀,化学反应方程式为:
反应,能生成硅铝酸盐沉淀,化学反应方程式为:
2Na2SiO3+2Na2═2Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中主要发生反应的离子方程式: ; .
(2)滤渣A的主要成分为 ;滤渣A的用途是(只写一种) .
查看答案和解析>>
科目:高中化学 来源: 题型:
对溶液中的离子反应存在下列几种说法,其中正确的是()
A. 不可能是氧化还原反应 B. 只能是复分解反应
C. 可能是化合反应 D. 不可能是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氧化物的叙述不正确的是()
①非金属氧化物不一定属于酸性氧化物
②酸性氧化物都属于非金属氧化物
③金属氧化物都属于碱性氧化物
④碱性氧化物都属于金属氧化物
⑤酸性氧化物都能与水反应生成相应的含氧酸
⑥两性氧化物既能与酸也能与碱反应生成盐和水
⑦不能与酸反应的氧化物一定能与碱反应
⑧与水反应生成含氧酸的氧化物一定是酸性氧化物.
A. ①②③⑥⑧ B. ②③⑤⑦⑧ C. ②③⑤⑥⑦ D. ②③④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列物质:
①Na2CO3 ②铜 ③氯化氢 ④CO2 ⑤NaHSO4 ⑥Ba(OH)2 ⑦氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩KI
(1)按物质的分类方法填写表格的空白处(填物质编号)
分类标准 电解 质 盐 非电解质 混合物
质 盐 非电解质 混合物
属于该类
的物质
(2)上述某两种物质在溶液中可发生离子反应:H++OH﹣═H2O,写出其中一个该离子反应对应的化学方程式 .
(3)物质⑩的稀溶液在空气中被氧化,加入淀粉溶液显蓝色,则反应的离子方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂.工业制高铁酸钠的方法有如下两种:
湿法制备的主要离子反应为:2Fe(OH)3+3ClO﹣+4OH﹣=2FeO42﹣+3Cl﹣+5H2O,
干法制备的主要反应方程为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
则下列有关说法正确的是()
A. 高铁酸钾中铁显+6价
B. 湿法中FeO42﹣是还原产物
C. 干法中每生成1mol Na2FeO4 转移4mol电子
D. K2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,可以说明金属甲比乙活泼性强的是()
A. 将甲乙作电极组成原电池时甲是负极
B. 甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出
C. 在氧化还原反应中,甲比乙失去的电子多
D. 同价态的阳离子,甲比乙的氧化性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com