
分析 氯气溶于水得到的溶液为氯水,溶解的氯气大部分以氯气分子形式存在,部分与水反应生成氯化氢和次氯酸,所以溶液既有酸性又具有漂白性,氯化氢为强电解质电离完全电离生成氯离子和氢离子,氯离子与银离子反应生成氯化银白色沉淀,据此解答.
解答 解:(1)氯气溶于水发生反应生成氯化氢和次氯酸,氯化氢溶于水电离产生氢离子溶液显酸性,而生成的次氯酸具有漂白性,所以加入紫色石蕊试液后会看到:溶液先变红后褪色;
故答案为:溶液先变红后褪色;氯气溶于水发生反应生成氯化氢和次氯酸,氯化氢溶于水电离产生氢离子溶液显酸性,而生成的次氯酸具有漂白性;
(2)氯气具有强的氧化性,能够氧化氯化亚铁生成氯化铁,浅绿色变为黄色,离子方程式:2Fe2++Cl2=2Cl-+3Fe3+;
故答案为:浅绿色变为黄色;2Fe2++Cl2=2Cl-+3Fe3+;
(3)氯水中含有盐酸,显酸性,加入Na2CO3溶液,反应生成二氧化碳,离子方程式:CO32-+2H+=H2O+CO2↑;
故答案为:气泡产生;CO32-+2H+=H2O+CO2↑;
(4)氯水中含有氯离子,氯离子能够与银离子反应生成氯化银,氯化银为白色不溶于硝酸的沉淀,反应离子方程式:
Ag++Cl-=AgCl↓;
故答案为:白色沉淀;Ag++Cl-=AgCl↓.
点评 本题考查了氯水的性质,熟悉氯水的成分及性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 铜加入稀硝酸中:Cu+4H++2NO3-=Cu2++NO↑+2H2O | |
| B. | 铵根离子检验:NH4++OH-$\frac{\underline{\;加热\;}}{\;}$NH3↑+H2O | |
| C. | 碳酸钙和盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 实验室用浓盐酸与MnO2制Cl2:MnO2+2H++2Cl-$\frac{\underline{\;加热\;}}{\;}$ Cl2↑+Mn2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的盐酸中:c(H+)=3.0mol•L-1 | |
| B. | NaHS溶液中:c(Na+)=c(HS-)+2c(S2-) | |
| C. | 饱和AgI溶液与饱和AgCl溶液相比,前者c(Ag+)大 | |
| D. | 碳酸氢钠溶液中既存在电离平衡,又存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有①②③ | C. | 只有②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使紫色石蕊试液变红的溶液中:Fe2+、Na+、SO42-、NO3- | |
| B. | 碱性溶液中:Na+、K+、NO3-、ClO- | |
| C. | pH=1的溶液中:Na+、Cu2+、Cl-、S2- | |
| D. | 加入Al能放出氢气的溶液中:NH4+、SO42-、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.5mol•L-1•min-1 | B. | v(C)=0.40 mol•L-1•min-1 | ||
| C. | v(B)=0.45 mol•L-1•s-1 | D. | v(A)=0.3mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物中都存在同分异构现象 | |
| B. | 只要含有的官能团种类相同就是同系物 | |
| C. | 14C和14Si是同位素 | |
| D. | C2H5Cl没有同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
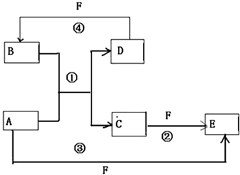 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出) .反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O
.反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com