
分析 (1)由反应方程式SO2+2H2S═3S↓+2H2O知,当SO2和H2S的物质的量之比为1:2,二者恰好完全反应生成硫单质和水,没有气体剩余,气体密度最小;
(2)由反应方程式知,当2mol H2S和1molSO2恰好反应时,氧化产物比还原产物多1mol,若2n>m,SO2过量,根据H2S的量进行计算;
(3)若5n=m,H2S过量,根据产物硫质量48g,结合反应方程式计算.
解答 解:(1)由反应方程式SO2+2H2S═3S↓+2H2O知,当SO2和H2S的物质的量之比为1:2,二者恰好完全反应生成硫单质和水,没有气体剩余,气体密度最小,若n=2,则当m=4 时,反应后容器内气体的密度最小;
故答案为:4;
(2)由反应方程式SO2+2H2S═3S↓+2H2O知,当2mol H2S和1molSO2恰好反应时,H2S被氧化生成2mol氧化产物,SO2被还原生成1mol还原产物,所以氧化产物比还原产物多1mol,若2n>m,SO2过量,根据H2S的量进行计算,则氧化产物为mmol,还原产物为0.5mol,所以反应后氧化产物与还原产物的质量差为0.5mmol×32g/mol=16m g;
故答案为:16m;
(3)由反应方程式SO2+2H2S═3S↓+2H2O知,若5n=m,H2S过量,
SO2 +2H2S═3S↓+2H2O
1 2 3
nmol 2nmol 3nmol
产物硫质量48g,即3nmol×32g/mol=48g,所以n=0.5mol,则m=2.5mol,所以n+m=3;
故答案为:3.
点评 本题考查了有关方程式的计算,题目难度中等,注意把握过量计算的方法,侧重于考查学生的分析能力和计算能力.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{W}{m+n+2}$×m mol | B. | $\frac{W}{m+n}$×m mol | C. | $\frac{W}{m+n+2}$×(m+2)mol | D. | $\frac{W}{m+n}$×(m-2)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠保存在煤油中 | |
| B. | 烧碱溶液盛装在带有玻璃塞的试剂瓶中 | |
| C. | 含有Fe3+的盐溶液遇KSCN 溶液变红 | |
| D. | 明矾(KAl(SO4)2•12H2O)可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色透明的酸性溶液:Cl-、Na+、MnO4-、SO42- | |
| B. | 能使pH试纸变深蓝色的溶液:Na+、NH4+、K+、CO32- | |
| C. | 加入过量NaOH溶液后可得到澄清的溶液:K+、Ba2+、HCO3-、Cl- | |
| D. | 常温下pH=12的溶液:K+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
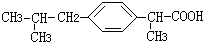
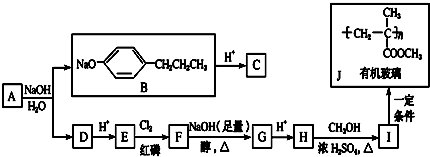
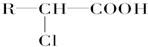 +HCl
+HCl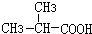 、G
、G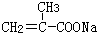 .
.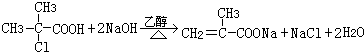 ;H→I
;H→I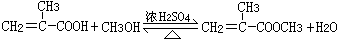 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向氢氧化钠溶液中滴加醋酸:H++OH-═H2O | |
| B. | 碳酸氢钙溶液中加入氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| C. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| D. | 在氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
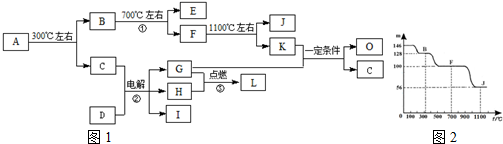
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com