


分析 废钯催化剂经烘干后,在700℃的高温下焙烧,C、Fe、Pd、有机物被氧气氧化生成氧化物,向氧化物中加入甲酸,甲酸和氧化铁反应生成盐和水,PdO和甲酸发生氧化还原反应生成Pd,滤渣中含有Pd、SiO2,二氧化硅不溶于王水,但Pd能溶于王水生成溶液,同时生成气体,加入浓氨水调节溶液PH,钯转变为可溶性[Pd(NH3)4]2+,使铁全部沉淀,溶液中加入盐酸酸析得到沉淀,经过脱氨等一系列操作得当氯化钯.
(1)PdO和甲酸发生氧化还原反应生成Pd,Pd的化合价降低,甲酸还原PdO生成Pd、CO2和H2O;
(2)根据Pd回收率与反应温度、反应时间、钯精渣和王水的质量比的关系确定适宜条件;
(3)①王水是浓硝酸与浓盐酸按体积比1:3混合而成的,硝酸具有氧化性,被还原为NO;
②钯在王水中溶解的过程中有化合物A,A中含有的元素为H、Pb、Cl,Cl的百分含量为1-42.4%-0.8%=56.8%;
(4)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,碱性溶液中铁离子钡沉淀为氢氧化铁,550℃焙烧2的目的是脱氨.
解答 解:废钯催化剂经烘干后,再在700℃的高温下焙烧,Fe、Pd、有机物被氧气氧化生成氧化物,向氧化物中加入甲酸,甲酸和氧化铁反应生成盐和水,PdO和甲酸发生氧化还原反应生成Pd,滤渣中含有Pd、SiO2,二氧化硅不溶于王水,但Pd能溶于王水生成溶液,同时生成气体,加入浓氨水调节溶液PH沉淀铁离子,得到溶液中中加入盐酸酸析得到沉淀Pd(NH3)2Cl2 ,通过脱氨等一系列操作得当氯化钯.
(1)PdO和甲酸发生氧化还原反应生成Pd,Pb的化合价降低,甲酸作还原剂,PdO和HCOOH发生氧化还原反应生成Pd、CO2和H2O,反应方程式为PdO+HCOOH=Pd+CO2↑+H2O,故答案为:还原剂;PdO+HCOOH=Pd+CO2↑+H2O;
(2)根据图象知,温度越高钯回收率越大,反应时间越长钯回收率越大,钯精渣与王水的质量比越大钯回收率越大,但90℃左右时温度再高钯回收率增大不大;8h后,随着时间的增长,钯回收率增大不大;当钯精渣与王水的质量比为1:8后,再增大钯精渣和王水的质量比,但钯回收率不大,所以适宜条件是80~90℃(或90℃左右)、反应时间约为8 h、钯精渣与王水的质量比为1:8,故答案为:80~90℃(或90℃左右);反应时间约为8h;钯精渣与王水的质量比为1:8;
(3)①王水是浓硝酸与浓盐酸按体积比1:3混合而成的,硝酸具有氧化性,被还原为无色有毒的气体NO,故答案为:NO;
②A中含有的元素为H、Pb、Cl,元素的质量分数分别为Pd:42.4%,H:0.8%,Cl:1-42.4%-0.8%=56.8%,故n(H):n(Pd):n(Cl)=2:1:4,则A的化学式为H2PdCl4,故答案为:H2PdCl4;
(4)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,碱性溶液中铁离子钡沉淀为氢氧化铁,脱氨将Pd(NH3)2Cl2变化为PdCl2,发生反应的化学方程式为Pd(NH3)2Cl2═PdCl2+2NH3↑,
故答案为:Fe(OH)3;Pd(NH3)2Cl2═PdCl2+2NH3↑.
点评 本题以Pd的提取为载体考查了工艺流程,涉及化学式的确定、氧化还原反应、图象分析等知识点,明确物质的性质是解本题关键,注意从整体上分析分析解答,知道每一步涉及的反应、物质分离的方法等知识点,结合元素守恒分析解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
 ;
; ;指出分子中化学键是共价键(填‘离子键’或‘共价键’).
;指出分子中化学键是共价键(填‘离子键’或‘共价键’).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 熔点 | 沸点 | |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
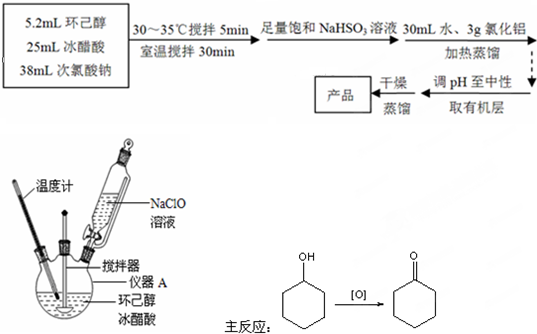
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
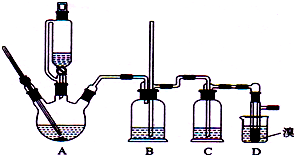 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
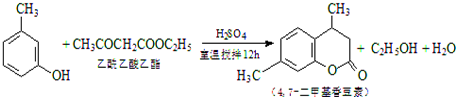
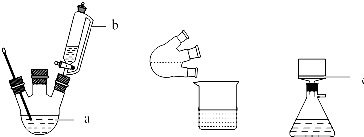
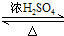 CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.
CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3 | B. | NH4NO3 | C. | (NH4)2SO4 | D. | NH4Br |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com