
| ① | ||||||
| ② | ③ | ④ | ||||
| ⑤ | ⑥ | ⑦ | ⑧ |
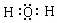 .
.分析 根据各元素在周期表中的相对位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl元素,
(1)⑦为Si,原子序数为14,位于周期表中第三周期、ⅣA族;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)离子的电子层越多,离子半径越大,电子层相同时,离子的核电荷数越大,离子半径越小;
(4)①和④分别为H、O元素,二者质重比为1:8时形成的化合物为水;
(5)⑥单质为Al,⑤的最高价氧化物的水化物为氢氧化钠,二者反应生成偏铝酸钠和水.
解答 解:根据各元素在周期表中的相对位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl元素,
(1)⑦为Si,其原子序数为14,原子核外电子总数为14,最外层含有4 电子,其位于周期表中第三周期ⅣA族,
故答案为:第三周期ⅣA族;
(2)②为C、③为N、⑦为Si,非金属性N>C>Si,则最高价氧化物对应水合物的酸性:HNO3>H2CO3>H2SiO3或(H4SiO4),
故答案为:HNO3>H2CO3>H2SiO3或(H4SiO4);
(3)④、⑤、⑥对应离子分别为O2-、Na+、Al3+,三种离子的电子层相同,离子的核电荷数越大离子半径越小,则离子半径大小为:O2->Na+>Al3+,
故答案为:O2->Na+>Al3+;
(4)①和④分别为H、O元素,二者质重比为1:8时形成的化合物为水,水分子为共价化合物,其电子式为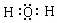 ,
,
故答案为: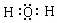 ;
;
(5)⑥单质为Al,⑤的最高价氧化物的水化物为NaOH,二者反应生成偏铝酸钠和水,反应的离子方程式为:2H2O+2Al+2OH-=2AlO2-+3H2↑,
故答案为:2H2O+2Al+2OH-=2AlO2-+3H2↑.
点评 本题考查了位置结构与性质关系的综合应用,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯与乙醇的分离可用分液操作 | |
| B. | 滴定管、容量瓶、分液漏斗等仪器,在使用前均须冼净并检查是否漏水 | |
| C. | 碘酒中加CCl4振荡睁置后,上层几乎为无色,下层为紫色 | |
| D. | 蒸馏、分馏和干馏都是利用物质沸点不同而将物质分离的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量的CH3COONa | B. | 向水中加入少量的NaHSO4 | ||
| C. | 加热水至100℃,pH=6 | D. | 向水中加少量的明矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 除杂质所用试剂和方法 | |
| A | KCl溶液 | I2 | CCl4,萃取分液 |
| B | CO2 | HCl | 饱和NaHCO3溶液,洗气 |
| C | Mg粉 | Al粉 | NaOH溶液,过滤 |
| D | CaCO3 | CaO | 盐酸,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
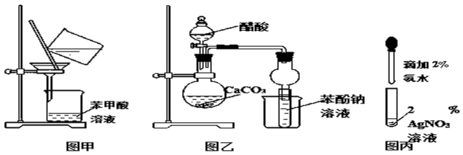
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 盐酸浓度增加一倍,使用量减半 | |
| B. | 盐酸浓度增加一倍,使用量增加一倍 | |
| C. | 增加碳酸钠的用量 | |
| D. | 盐酸浓度不变,使用量减半 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com