
【题目】下列有关电解质溶液的说法不正确的是( )
A.向0.1mol·L-1 CH3COONa溶液中加入少量水,溶液中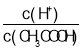 减小
减小
B.将FeCl3溶液和Fe2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分不同
C.向盐酸中加入氨水至中性,溶液中![]() =1
=1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
【答案】B
【解析】
A、向0.1molL-1CH3COONa溶液加入少量水,水解程度增大,n(H+)减小,n(CH3COOH) 增大,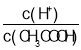 减小,选项A正确;
减小,选项A正确;
B、将FeCl3溶液和Fe2(SO4)3溶液分别加热、蒸干、灼烧,由于HCl易挥发,则加热氯化铁溶液最终得到的是氧化铁,而加热硫酸铁溶液最终得到的是硫酸铁,所得固体成分不同,选项B错误;
C、向盐酸中加入氨水至中性,溶液中电荷守恒为c(Cl-)+c(OH-)=c(NH4+)+c(H+),显中性,即c(OH-)=c(H+),所以c(Cl-)=c(NH4+),![]() =1,选项C正确;
=1,选项C正确;
D、AgCl、AgBr的饱和溶液中存在AgCl(s)+Br-AgBr(s)+Cl-,该反应的平衡常数K=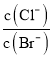 ,向溶液中加入少量AgNO3,K不变,选项D正确。
,向溶液中加入少量AgNO3,K不变,选项D正确。
答案选B。


科目:高中化学 来源: 题型:
【题目】将少量稀盐酸滴加到盛有碳酸钙的U形管中,可观察到U形管中的脱脂棉剧烈燃烧。
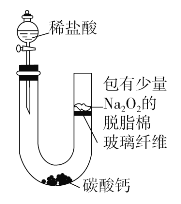
(1)稀盐酸与碳酸钙反应的离子方程式是__________________________
(2)从脱脂棉的燃烧可以推出Na2O2与CO2反应的结论是a.________________,b.________________。
(3)Na2O2与CO2反应的化学方程式是_________________________,还原剂是________,氧化剂是________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功实现了电解气态HCl制备Cl2,其工作原理如图所示。下列说法错误的是( )
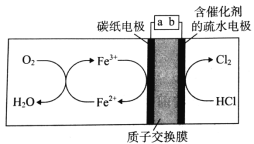
A.a为外接直流电源的负极
B.阳极的电极反应为2HCl - 2e- ═ Cl2 + 2H+
C.通电后H+从左室迁移至右室
D.左室中发生反应为4Fe2+ + O2 + 4H+ ═ 4Fe3+ + 2H2O,实现了Fe3+的再生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.1mol·L-1的NaOH溶液分别滴定体积均为10.00mL、浓度均为0.1mol·L-1的盐酸和CH3COOH溶液,利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是( )
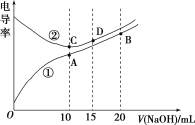
A.曲线①代表滴定CH3COOH溶液的曲线
B.A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol·L-1
C.在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C
D.D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是( )
A. 2p和3p轨道形状均为哑铃形,能量也相等
B. 氮原子的价电子排布图:![]()
C. 利用手性催化剂合成可得到一种或主要得到一种手性分子,手性异构体性质相同
D. 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用下图装置制取少量氯化铝,已知氯化铝熔沸点都很低(178℃升华),且易水解。下列说法中完全正确的一组是
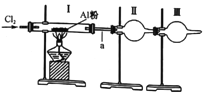
①氯气中含的水蒸气和氯化氢可通过盛有苛性钠的干燥管除去
②装置I中充满黄绿色气体后,再加热盛有A铝粉的硬质玻璃管
③装置II是收集装置,用于收集氯化铝
④装置III可盛放碱石灰也可盛放无水氯化钙,二者的作用相同
⑤a处使用较粗的导气管实验时更安全
A. ①② B. ②③⑤ C. ①④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是( )

A. 二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为配位键
B. lmol环戊二烯(![]() )中含有
)中含有![]() 键的数目为11NA
键的数目为11NA
C. 二茂铁分子中存在π键
D. Fe2+的电子排布式为ls 22s 22p63s23p63d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)为白色结晶粉末,易溶于水,在中性或碱性条件下稳定,在酸性条件下发生反应(S2O32-+2H+=S↓+SO2+H2O),是一种重要的化工原料。请回答下列问题:
(1)Na2S2O3溶液可用作照相底片(AgBr)中的定影剂,其原理是将未感光的AgBr转化为可溶于水的稳定络合物Na3[Ag(S2O3)2]。写出该络合反应的离子方程式___。
(2)工业上利用硫化碱残渣(主要成分Na2S,Na2CO3)与硫黄废气(主要成分SO2)反应,经吸硫、蒸发、结晶,制得硫代硫酸钠。巳知该反应中C(碳)原子化合价不变,则氧化剂和还原剂物质的量之比为___。
(3)Na2S2O3长期暴露在空气中易被氧化生成Na2SO4,设计实验方案检验Na2S2O3是否变质(已知BaS2O3微溶于水)___。
(4)现有含Na2S2O3·5H2O的样品,用以下方法计算Na2S2O3·5H2O的质量分数。
a.取样品7.0g溶于蒸馏水中,并定容至500mL容量瓶中待用。
b.取0.01mol.L-1的K2Cr2O7标准溶液20.00mL于锥形瓶中,加过量KI溶液并酸化,加2滴淀粉指示剂,用a中未知浓度的Na2S2O3待测液滴定至终点,共用去25.00mL。(已知2S2O32-+I2=S4O62-+2I-),在酸性环境中Cr2O72-被还原为绿色的Cr3+)。
回容下列问题:
①滴定终点的现象是___。
②样品中Na2S2O3·5H2O的质量分数为___(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是
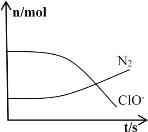
A. 该反应中Cl-为氧化产物
B. 消耗1mol还原剂,转移6mol电子
C. NH4+被ClO-氧化成N2
D. 反应后溶液的酸性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com