
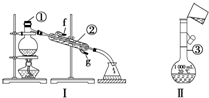
 掌握仪器的名称及使用方法是化学实验的基础,如图所示为两套实验装置.
掌握仪器的名称及使用方法是化学实验的基础,如图所示为两套实验装置.分析 (1)由图可知仪器的名称;
(2)装置Ⅰ分离四氯化碳和苯的混合物,需要温度计测定馏分的温度,冷水下进上出;
(3)图中转移液体需要玻璃棒引流、容量瓶规格不合理;摇匀后发现液面低于刻度线,继续滴加蒸馏水至刻度线,V偏大.
解答 解:(1)由图可知①②③分别为蒸馏烧瓶、冷凝管、1 000mL容量瓶,故答案为:蒸馏烧瓶;冷凝管;1 000mL容量瓶;
(2)四氯化碳和苯互溶,利用沸点的差异,可用蒸馏的方法分离二者,图中缺少温度计.冷却水从下口进入,从上口流出,原则上与蒸气的流向相反,即g口进入,
故答案为:温度计;蒸馏;g;
(3)向容量瓶中转移液体,必须用玻璃棒引流;注意容量瓶的规格应为250mL.定容后,盖上玻璃塞倒转摇匀,发现液面低于刻度线,原因是部分溶液附着在瓶塞或磨口处,此时如果继续滴加蒸馏水,则溶液的体积大于250mL,由c=$\frac{n}{V}$可知物质的量浓度偏低,
故答案为:未用玻璃棒引流、未采用250mL容量瓶;偏低.
点评 本题考查混合物分离提纯,为高频考点,把握图中实验装置、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意实验技能的训练,题目难度不大.


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:选择题
| A. | ②④⑦⑧⑨⑩ | B. | ②③④⑦⑨⑩ | C. | ①③④⑦⑩ | D. | ③④⑤⑦⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
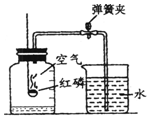 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中不正确的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中不正确的是( )| A. | 该实验证明空气中氧气的质量分数约占$\frac{1}{5}$ | |
| B. | 实验时红磷要足量 | |
| C. | 实验前一定要检查装置的气密性 | |
| D. | 红磷燃烧的火焰熄灭后立刻打开弹簧夹 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com