
| ||
| △ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
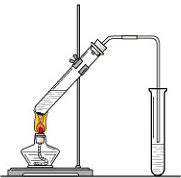 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中还原产物是NO |
| B、氧化产物和还原产物的物质的量之比为1:8 |
| C、反应过程中转移的电子数为4e- |
| D、化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
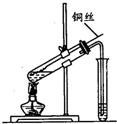 如图是实验室研究浓硫酸性质的实验,下列分析错误的是( )
如图是实验室研究浓硫酸性质的实验,下列分析错误的是( )| A、该实验说明浓硫酸具有强氧化性 |
| B、反应后试管中观察到的白色固体CuSO4 |
| C、该实验产生的气体不会造成环境污染,因此不需尾气处理 |
| D、实验结束,将铜丝拉离液面终止反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2通入饱和碳酸钠溶液中 |
| B、在稀硫酸中加入铜粉,再加入KNO3固体 |
| C、NO2通入FeSO4溶液中 |
| D、SO2通入饱和CaCl2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实现现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气中以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
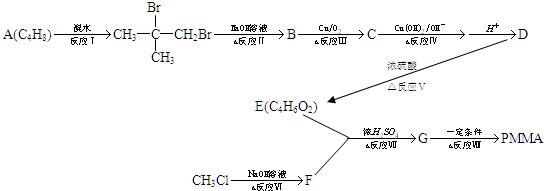
 实验室制取乙酸乙酯的主要步骤如图:
实验室制取乙酸乙酯的主要步骤如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com