
【题目】我国科学家在某杂志上发表研究报告称,利用铬同位素的系统分析发现,“古代大气氧含量高于现代水平的1%”。铬的同位素有![]() 、
、![]() 、
、![]() 、
、![]() 。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
(1)基态![]() 的价层电子排布图为_________
的价层电子排布图为_________
(2)交警用“酒精仪”查酒驾,其化学反应原理如下:
2K2Cr2O7+3CH3CH2OH+8H2SO4→3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O
①CH3CH2OH、CH3COOH的沸点高于对应的CH3OCH3(二甲醚)、HCOOCH3(甲酸甲酯),其主要原因是___________。
②CH3COOH分子中碳原子的杂化类型是______;CH3COOH分子中σ键和π键数目之比为_________。
③K2SO4晶体中阴离子的空间构型是________。上述反应中,只含极性键的极性分子有________(填分子式)。
(3)晶体铬的晶胞结构如图1所示,其堆积模型为___________;铬原子的配位数为___________。

(4)铬的一种氧化物晶胞结构如图2所示。六棱柱边长为a nm,高为b nm,NA代表阿伏加德罗常数的值。该晶体的化学式为______;该晶体的密度ρ=_______g·cm-3。
【答案】![]() CH3CH2OH、CH3COOH分子间存在氢键 sp2、sp3 7:1 正四面体形 H2O、H2SO4 体心立方堆积 8 Cr2O3
CH3CH2OH、CH3COOH分子间存在氢键 sp2、sp3 7:1 正四面体形 H2O、H2SO4 体心立方堆积 8 Cr2O3 ![]()
【解析】
(1)Cr为24号元素,其核外电子排布为1s22s22p63s23p63d54s1,价电子为3d54s1,根据洪特规则,电子分别占据不同的轨道,所以价层电子排布图为![]() ;
;
(2)①在乙醇和乙酸中均有O—H键,类似于水一样,分子间可以形成氢键,使物质的熔沸点升高。
②乙酸的结构式为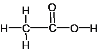 。C原子杂化类型可以从其周边的原子数判断,甲基上的C原子形成4个σ键,C上没有孤电子对,C原子的杂化类型为sp3;羧基中C形成3个σ键和1个π键,C上没有孤电子对,C原子的杂化类型为sp2。单键均为σ键,而且碳氧双键中有1个σ键和1个π键,一共有7个σ键和1个π键,则σ键和π键的比例为7:1;
。C原子杂化类型可以从其周边的原子数判断,甲基上的C原子形成4个σ键,C上没有孤电子对,C原子的杂化类型为sp3;羧基中C形成3个σ键和1个π键,C上没有孤电子对,C原子的杂化类型为sp2。单键均为σ键,而且碳氧双键中有1个σ键和1个π键,一共有7个σ键和1个π键,则σ键和π键的比例为7:1;
③SO42-的中心原子S上孤电子对数为![]() ×(6+2-4×2)=0,价层电子对数为0+4=4,S为sp3杂化,SO42-的空间构型为正四面体构型。化学方程式中2K2Cr2O7+3CH3CH2OH+8H2SO4→3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O,属于分子的有CH3CH2OH、H2SO4、CH3COOH、H2O。CH3CH2OH、CH3COOH中都有C—C非极性键,只有极性共价键的是H2SO4、H2O,而且H2SO4、H2O都属于极性分子;
×(6+2-4×2)=0,价层电子对数为0+4=4,S为sp3杂化,SO42-的空间构型为正四面体构型。化学方程式中2K2Cr2O7+3CH3CH2OH+8H2SO4→3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O,属于分子的有CH3CH2OH、H2SO4、CH3COOH、H2O。CH3CH2OH、CH3COOH中都有C—C非极性键,只有极性共价键的是H2SO4、H2O,而且H2SO4、H2O都属于极性分子;
(3) 晶体铬中,Cr占据了顶点和体心,所以为体心立方堆积。离中间的Cr原子最近的有8个Cr,所以其配位数为8;
(4)以整个六棱柱为整体,有4个Cr在其中,完全属于此晶胞。有3个O原子在晶胞内,完全属于此晶胞,还有2个O在面上,为2个面共用,因此有![]() 个O原子,在顶点有12个O原子,每个O原子为6个晶胞共有,因此有
个O原子,在顶点有12个O原子,每个O原子为6个晶胞共有,因此有![]() 个O原子,共3+1+2=6个O原子,Cr和O的比例为2:3,则化学式为Cr2O3。
个O原子,共3+1+2=6个O原子,Cr和O的比例为2:3,则化学式为Cr2O3。![]() ,晶胞中有4个Cr和6个O,则晶胞的质量
,晶胞中有4个Cr和6个O,则晶胞的质量![]() 。晶胞的体积
。晶胞的体积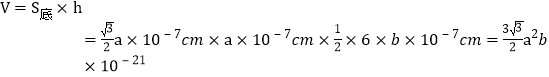 cm3,带入,得
cm3,带入,得![]() 。
。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】铬元素有许多独特性质,如铬作为炼钢的添加料,可生产多种高强度、抗腐 蚀、耐磨、耐高温、耐氧化的特种钢;铬的化合物色彩众多,如 Cr3+(紫色)、Cr(OH)3(灰蓝色)、 CrO2(绿色)等。请回答下列问题:
Ⅰ.铬可形成 Cr(NO3)3、NaCrO2 等盐类物质,则 NaCrO2 中铬元素的化合价为_____,向Cr(NO3)3 溶液中滴加 NaOH 溶液至过量,可观察到的主要现象是_____。
Ⅱ.铬元素的+6 价化合物毒性较大,不能随意排放。某化工厂以铬渣(含有 Na2SO4 及少量Cr 2O72、Fe3+)为原料提取硫酸钠,同时制备金属铬的工艺流程如下:

已知:金属离子生成氢氧化物沉淀的 pH 如下表所示:
氢氧化物 | Fe(OH)3 | Cr(OH)3 |
开始沉淀的 pH | 1.5 | 6 |
沉淀完全的 pH | 3.6 | 8 |
(1)滤渣 A 的主要成分为_____。
(2)根据下图信息,可知操作 B 包含蒸发结晶和_____。

(3)酸化后的 Cr2O72-可被 SO32-还原,该反应中若有 0.5 molCr2O72-被还原为 Cr3+ ,则消耗 SO32-的物质的量为_____mol。
(4)调 pH 沉铬步骤中,应调节 pH 的范围是_____(填字母)。
A.1.5~3.6 B.3.6~6 C.6~8 D.8~9
(5)通过两步反应可以实现Cr(OH)3转化为 Cr,第一步反应为2Cr(OH)3=Cr2O3+3H2O;第二步反应利用了铝热反应原理,则该步反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应的反应过程中能量变化如图所示![]() (图中
(图中![]() 表示正反应的活化能,
表示正反应的活化能,![]() 表示逆反应的活化能
表示逆反应的活化能![]() 下列有关叙述正确的是
下列有关叙述正确的是

A. 该反应为放热反应
B. 催化剂能改变反应的焓变
C. 催化剂能降低反应的活化能
D. 生成物分子成键时释放出的总能量大于反应物分子断键时吸收的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用相应的化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)表中用序号标出的10种元素中,化学性质最不活泼的元素的原子结构示意图是_____________________________。
(2)④、⑥、⑧的原子半径由小到大的顺序为___________(用元素符号作答)。
(3)②、③、⑨的最高价氧化物的水化物的酸性由弱到强的顺序是______________(用化学式作答)。
(4)由表中两种元素的原子按1:1组成的共价化合物M,M为常见液态化合物,其稀溶液易被催化分解,请写出M的电子式_____________,M的结构式_____________。
(5)写出⑦元素的最高价氧化物对应水化物分别与元素⑥、⑧的最高价氧化物对应水化物的水溶液反应的离子方程式_____________、_____________。
(6)⑥的金属性强于⑦,下列表述中能证明这一事实的是_____________。
a.⑥的单质和⑦的单质熔沸点不同
b.⑥的最高价氧化物水化物的碱性比⑦的最高价氧化物水化物的碱性强
c.⑦最外层的电子数比⑥多
d.⑦的单质与稀盐酸反应比⑥的缓和一些
(7)①和④形成的气态氢化物与①和⑧形成的气态氢化物相比较,_____________沸点高(填化学式),理由是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
①标准状况下,1LHCl和1LH2O的物质的量相同;
②常温常压下,1gH2和14gN2的体积相同;
③28gCO的体积为22.4L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤同温同体积时,气体的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比
A. ①③④⑥B. ②⑤⑥C. ⑤⑥D. ①⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清华大学王晓琳教授首创三室膜电解法制备LiOH,其工作原理如图所示,下列有关说法正确的是

A. X电极连接电源负极
B. N为阳离子交换膜
C. Y电极反应式为 O2+2H2O+4e-=4OH-
D. 制备2.4g LiOH产生的H2在标准状况下为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) ![]() CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是 ( )
CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是 ( )
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,我国科研团队研发出一种蓝藻人造叶片系统,其核心是一种可以向细胞外分泌蔗糖的蓝藻,其工作原理如图。下列说法不正确的是

A. 该系统利用了蓝藻的光合作用
B. 理论上,系统出水量小于进水量
C. 可用银氨溶液检验产物中是否含蔗糖
D. 该系统有望为人类探索太空时解决生存难题提供新思路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50 mg,则( )
A. 被氧化的砒霜为1.98 mg
B. 分解产生的氢气为 0.672 mL
C. 和砒霜反应的锌为3.90 mg
D. 生成砷化氢时,转移的电子总数为6×10-5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com