
对于反应A(g)+3B(g)  2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
A、v(A)=0.01 mol/(L•s) B、v(B)=0.02 mol/(L•s)
C、v(B)=0.60mol/(L•min) D、v(C)=1.0mol/(L•min)
科目:高中化学 来源: 题型:
某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。
(1)查阅资料知NaHSO3与过量KIO3反应分为以下两步进行,第一步为IO3-+ 3HSO3-=3SO42-+3H+ + I-,则第二步反应的离子方程式为_____________________________
(2)通过测定溶液变蓝所用时间探究浓度和温度对该反应的反应速率的影响。调节反应物浓度和温度进行对比实验,记录如下:
| 实验编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
| ① | 15 | 20 | 10 | 15 | t1 |
| ② | a | 30 | 0 | 15 | t2 |
| ③ | 15 | b | c | 30 | t3 |
实验①②是探究______________对反应速率的影响,表中a=________;实验①③是探究温度对反应速率的影响,则表中b=________,c=________
(3)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设三:
假设一:反应生成的SO42-对反应起催化作用,SO42-浓度越大反应速率越快;
假设二:反应生成的H+对反应起催化作用,H+浓度越大反应速率越快;
假设三:__________________________________________________________;
……
(4)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题:
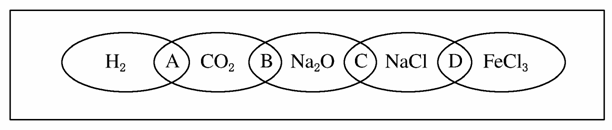
(1)请将分类依据代号填入相应的括号内:
( )两种物质都不是电解质
( )两种物质都是钠的化合物
( )两种物质都是氧化物
( )两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色,制得物质N。
①物质M的化学式为______________________。
②将物质N接通直流电源,________极附近的颜色逐渐加深,________极附近的颜色逐渐变浅。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列氧化反应属于吸热反应的是( )
A.工业上制氨气的反应 B.葡萄糖在人体内氧化分解
C.锌粒与稀H2SO4反应制取H2 D.Ba(OH)2·8H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个固定体积的密闭容器中,加入2molA和1molB,发生反应:
2A(气) + B(气) 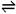 3C(气) + D(气)
3C(气) + D(气)
达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
A. 4molA+2molB B. 2molA+1molB+3molC+1molD
C. 3molC+1molD+1molB D. 3molC+1molD
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
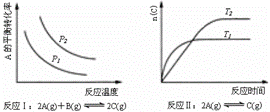
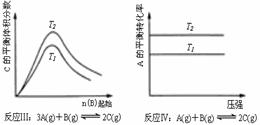
根据以上规律判断,上列结论正确的是( )
A.反应Ⅰ:△H>0,P2>P1 B.反应Ⅱ:△H>0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 D.反应Ⅳ:△H<0,T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1) 过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式:
(2) Na2O2 、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是____________(写电子式),
(3) 臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:
KI+O3+H2O→KOH+I2+O2(未配平 ) 回答问题:
① 还原产物的化学式为
② 配平后的化学方程式是
(4)O3 可由臭氧发生器(原理如图8所示)电解稀硫酸制得。
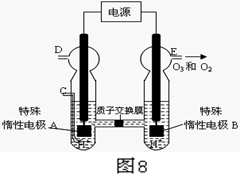

①图中阴极为 (填“A”或“B”)。
② 若C处不通入O 2 ,D、E处分别收集到11.2L和4.48L
气体(标准状况下), 则E处收集的气体中O3所占的体积分数
为 (忽略 O 3 的分解)。
③ 若C处通入O 2,则A极的电极反应式为: 。
(5)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+ O3 (g) NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如图9)所示。由图可得出的正确说法是
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如图9)所示。由图可得出的正确说法是

a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.反应物的总能量低于生成物的总能量
d.Δt1=Δt2时,NO的转化率:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
在酸性溶液中,能大量共存的离子组是( )
A.Mg2+、Fe3+、NO 、SCN-
、SCN-
B.Al3+、Fe2+、Cl-、SO
C.K+、Na+、Cl-、HCO
D.Na+、Ca2+、NO 、OH-
、OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com