
���� ��1���ֱ����ء�����ص����ʵ�������Ϸ���ʽ���㣻
��2��K2O2��K2O2������������110��32��
��3��13.2L����״����CO2��KO2��Ӧ�����������Ϊ18.8L���ɽ�Ϸ���ʽ�����ò��������㣻
��4����A��ƽ����ѧʽΪ KxOy�����ݷ�ӦKxOy+$\frac{x}{2}$CO2�T$\frac{x}{2}$K2CO3+$\frac{1}{2}$��y-0.5x��O2���м��㣮
��� �⣺��1��n��K��=$\frac{39g}{39g/mol}$=1mol��n��KNO3��=$\frac{10.1g}{101g/mol}$=0.1mol���ɷ���ʽ10K+2KNO3��6K2O+N2��֪��K�������������ȫ��Ӧ����Ӧ����0.3molK2O��
������0.3mol��94g/mol=28.2g��
�ʴ�Ϊ��28.2��
��2��K2O2��K2O2������������110��32��ij����������Ʒ�������������������ʲ�������Ϊ0.28������Ʒ��K2O2����������Ϊ0.28��$\frac{110}{32}$��100%=96.25%��
�ʴ�Ϊ��96.25%��
��3��4KO2+2CO2��2K2CO3+3O2 ��V
4mol 4.8L 67.2L 22.4L
n 5.6L
n=$\frac{4mol��5.6L}{22.4L}$=1mol��
m��KO2��=1mol��71g/mol=71g��
�𣺷�Ӧ���ĵ�KO2������Ϊ71g��
��4����A��ƽ����ѧʽΪ KxOy��
KxOy +$\frac{x}{2}$CO2�T$\frac{x}{2}$K2CO3 +$\frac{1}{2}$��y-0.5x��O2
39x+16y 11.2��y-0.5x��
6.3 1.12
$\frac{39x+16y}{6.3}$=$\frac{11.2��y-0.5x��}{1.12}$
���x��y=2��3��
����n��K����n��O��=2��3��
����A�м�������ԭ�Ӹ���֮��2��3��
��n��K����n��O��=2��3�������û�ѧʽ����Ϊ��KO2��K2O2 ��KO2��K2O��
����ԭ���غ㷨�ɵ�n��KO2����n��K2O2��=2��1��n��KO2����n��K2O��=4��1��
��A�м�������ԭ�Ӹ���֮��Ϊ2��3��K2O2��KO2 1��2��K2O��KO2 1��4��
���� ���⿼���йػ�ѧ����ʽ�������㣬�漰���������������غ��Ӧ�ã���Ŀ�Ѷ��еȣ������ڿ���ѧ���ķ��������ͼ���������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 L��Һ��K+Ũ����0.4 mol•L-1 | |
| B�� | ��Һ�к���0.4NA��K+ | |
| C�� | 1 L��Һ������K+��SO42-����Ϊ0.3NA | |
| D�� | 2 L��Һ��SO42-Ũ����0.4 mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| װ�� | ҩƷ | ���� | |
| ʵ��1 |  | 0.64g CuƬ��0.01mol����20.0mLŨHNO3 | CuƬ��ʧ���õ���ɫ��ҺA�����ýϳ�ʱ���õ���ɫ��ҺB���� |
| ���� | ���� | |
| ʵ��3 | i����������ҺA��c��H+����ͬ��HNO3��Һ��ȡ20.0mL��ͨ��NO2���� | ��Һ�ʻ�ɫ |
| ii���ټ�0.01mol Cu��NO3��2�����������ȫ�ܽ� | ��Һ��Ϊ��ɫ | |
| 3����ˮϡ�� | ��Һ������Ϊ��ɫ | |
| ʵ��4 | i����20.0mL 0.5mol/L Cu��NO3��2��ɫ��Һ��ͨ������NO2 | ��Һ����ɫ |
| ii������ϡH2SO4 | ����ɫ����ų��������������ɫ����Һ�ܿ��Ϊ��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

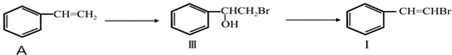


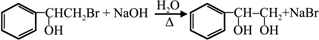

 ��BrMgCH2��CH2��3CH2MgBr��һ�������·������Ʒ�Ӧ�ٵķ�Ӧ�����ɵ��л��������������ʽΪC16H17N���Ľṹ��ʽΪ
��BrMgCH2��CH2��3CH2MgBr��һ�������·������Ʒ�Ӧ�ٵķ�Ӧ�����ɵ��л��������������ʽΪC16H17N���Ľṹ��ʽΪ ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ����˵����ȷ���ǣ�������
����˵����ȷ���ǣ�������| A�� | ������ | B�� | �����ͬϵ�� | ||
| C�� | �����12��ԭ�ӹ��� | D�� | �ܷ���������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | Cu | B�� | CO2 | C�� | NH3 | D�� | CH3CH2OH���Ҵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������0.1 mol Znʱ���õ��Ļ�ԭ����Ϊ0.1 mol | |
| B�� | ����Һ�в��ٲ�������ʱ����Һ�д������ڵ���������Zn2+ | |
| C�� | ���е����ֵ�������ʱ�����ĵ�п���������ٴ���13 g | |
| D�� | ��Ӧ����ʱ���ɵõ�0.25 mol ZnSO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
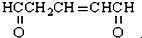 �����������������Ʊ���������ͭ��Ӧ�����ĵ�������������ͭ�����ֱ�Ϊ��������
�����������������Ʊ���������ͭ��Ӧ�����ĵ�������������ͭ�����ֱ�Ϊ��������| A�� | 1 mol��2 mol | B�� | 1 mol��4 mol | C�� | 3 mol��2 mol | D�� | 3 mol��4 mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com