
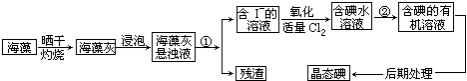
分析 从海带中提取碘:海带灼烧后得到海带灰浸泡后得到海带灰的浊液,将悬浊液分离为残渣和含碘离子溶液应选择过滤的方法,过滤得到含碘离子的溶液,通入适量Cl2,将碘离子氧化成单质碘,离子方程式为:2I-+Cl2=I2+2Cl-,得到含碘的水溶液,加入有机溶剂,萃取分液得到含碘的有机溶液,通过蒸馏得到碘单质.
(1)①是将悬浊液分离成清液和残渣,故操作是过滤;②是将碘从溶剂水中提取到另一溶剂(有机溶剂)中,故此操作是萃取;过程②为碘化钾被氯气氧化成碘的反应;
(2)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多;
(3)萃取分液用的仪器是分液漏斗,故此处缺少的玻璃仪器是分液漏斗.
解答 解:(1)①分离固体和液体用过滤,海带灼烧后得到海带灰浸泡后得到海带灰的浊液,将悬浊液分离为残渣和含碘离子溶液应选择过滤的方法,
②利用溶质在互不相溶的溶剂里溶解度不同,用一种溶剂把溶质从它跟另一种溶剂所组成的溶液里提取出来,这种方法叫做萃取,含碘的水溶液,加入有机溶剂,萃取分液得到含碘的有机溶液,过滤得到含碘离子的溶液,通入适量Cl2,将碘离子氧化成单质碘,方程式为:2KI+Cl2=I2+2KCl,
故答案为:过滤;萃取;KI+Cl2=I2+2KCl;
(2)萃取剂不能与水混溶,故A.酒精;C.乙酸;D.甘油都不可做萃取剂;B.四氯化碳、苯和水不互溶,且碘在其中的溶解度大于水,符合萃取剂的要求,
故答案为:B;
(3)使海藻灰中碘离子转化为碘的有机溶液,需进行萃取分液,萃取分液必须用到分液漏斗,所以除上述已知仪器外,缺少分液漏斗,
故答案为:分液漏斗.
点评 本题考查物质的分离和提纯,学习中注意掌握过滤、萃取等操作,题目难度不大.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3═N2↑+3Cl-+3H2O | |
| B. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| C. | NaAlO2溶液中AlO2-的水解:AlO2-+2H2O═Al(OH)3↓+OH- | |
| D. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加入Na0H溶液并加热,鉴别地沟油(餐饮废弃油)和矿物油(汽油、煤油等) | |
| B. | 为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液 | |
| C. | 为探究温度对化学反应速率的影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| D. | 往含有FeBr2和FeI2的混合溶液中通足量的氯气,然后把溶液蒸干、灼烧,得到FeCl3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
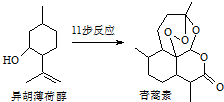 2015年诺贝尔生理学、医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年诺贝尔生理学、医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇的分子式为C10H12O | |
| B. | 青蒿素提取时可以通过加热或加碱溶解的方法提高其浸取率 | |
| C. | 青蒿素易溶于水,而难溶于有机溶剂 | |
| D. | 异胡薄荷醇可发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油中绝不含铅元素 | B. | 汽油中不人为添加含铅元素的物质 | ||
| C. | 汽油中含铅元素在一定指标范围内 | D. | 以上都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
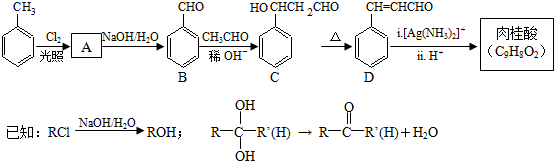
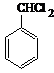 .
.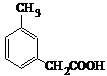 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ①③⑤ | C. | ①③④⑦ | D. | ①③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com