
| A. | 醋酸可用作调味剂及防腐剂 | B. | CO2和CH4都是温室气体 | ||
| C. | 阿司匹林可用作抗酸药 | D. | 植物油可用于制备人造黄油 |
分析 A.食醋具有酸性,能作调味剂,还能杀菌消毒;
B.CO2、CH4、N2O、臭氧等气体都是主要的“温室气体”;
C.阿司匹林能够解热镇痛药;
D.植物油为不饱和油脂,人造黄油为饱和油脂.
解答 解:A.食醋在水溶液里电离出氢离子而使其溶液弱酸性,所以能作调味剂;食醋具有酸性,能使蛋白质变性而细菌消毒,所以食醋作调味剂、防腐剂,故A正确;
B.CO2和CH4都是温室气体,故B正确;
C.阿司匹林是一种常用的解热镇痛药,不是抗酸药,故C错误;
D.不饱和油脂与氢气加成可以生成饱和油脂,故D正确;
故选:C.
点评 本题考查了常见食品添加剂的组成、性质和作用,药物的疗效,熟悉常见食品添加剂的组成和性质、常见药物的疗效是解题关键,注意对相关知识的积累.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:解答题
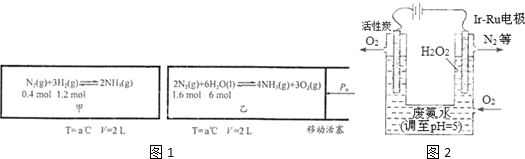
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
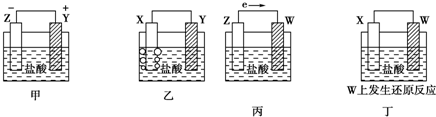
| A. | Z>Y>X>W | B. | Z>X>Y>W | C. | Z>Y>W>X | D. | Y>Z>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
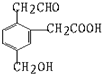 某有机物的结构式为它在一定条件下(如图)能发生的反应有( )
某有机物的结构式为它在一定条件下(如图)能发生的反应有( )| A. | ②③④ | B. | ①③⑤⑥ | C. | ①③④⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
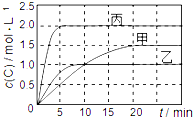 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 1L | 1L | 2L |
| 温度 | T1 | T2 | T2 |
| 反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
| A. | 由图可知:T1<T2,且该反应为吸热反应 | |
| B. | T1时该反应的平衡常数K=7.2 | |
| C. | 前10min甲、乙、丙三个容器中A的反应速率:v(A)甲<v(A)乙<v(A)丙 | |
| D. | 平衡时A的质量m:m乙<m甲<m丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强氧化性和脱水性 | B. | 强氧化性和吸水性 | ||
| C. | 难挥发性和酸性 | D. | 脱水性和吸水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
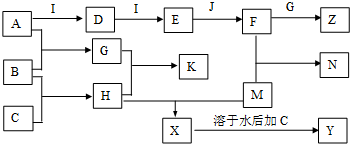
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定某NaOH溶液的浓度,通常用已润洗的酸式滴定管放出25.00mL标准盐酸溶液于锥形瓶中,加2滴酚酞,然后向已润洗的碱式滴定管中注入未知浓度的NaOH溶液进行滴定 | |
| B. | 用无水CuSO4 、BaCl2溶液、稀盐酸、NaOH溶液、红色石蕊试纸、KSCN溶液、新制氯水等试剂可确定摩尔盐的化学式 | |
| C. | 通常采用产生气泡的快慢,来比较不同条件下Na2S2O3溶液与稀硫酸的反应速率 | |
| D. | 萃取操作所用的分液漏斗使用前应加入少量水,见旋塞芯处是否漏水,待确认不漏水后则可以使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com