
已知铍(Be)的原子序数为4.下列对铍及其化合物的叙述中,正确的是( )
|
| A. | 铍的原子半径小于硼的原子半径 |
|
| B. | 氧化铍分子中铍原子的最外层电子数是8 |
|
| C. | 氢氧化铍的碱性比氢氧化钙的弱 |
|
| D. | 单质铍跟冷水反应产生氢气 |
考点:
同一主族内元素性质递变规律与原子结构的关系;同一周期内元素性质的递变规律与原子结构的关系.
专题:
元素周期律与元素周期表专题.
分析:
根据元素在同一周期半径的变化规律:从左到右原子半径逐渐减小;同一主族元素性质的递变规律:从上到下金属性逐渐增强等规律来分析解答.
解答:
解:A、同一周期,从左到右,元素原子半径逐渐减小,所以铍的原子半径大于硼的原子半径,故A错误;
B、铍(Be)的外层电子数为2,BeO分子中铍原子的最外层电子数是4,故B错误;
C、同一主族,从上到下,元素的金属性逐渐增强,所以钙的金属性强于铍,氢氧化钙的碱性比钙氢氧化铍的强,故C正确;
D、同一主族,从上到下,元素的金属性逐渐增强,所以镁的金属性强于铍,而镁与冷水不反应,所以铍跟冷水不反应,故D错误;
故选:C.
点评:
本题主要考查学生对元素周期律知识的理解与掌握,并能在解题中灵活应用,题目比较简单,明确同周期和同主族元素性质的递变规律是解题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
一种气态烷烃和一种气态烯烃组成的混合物共10g,混合气体的密度是相同状况下H2密度的12.5倍.该混合气体通过装有溴水的试剂瓶时,试剂瓶的质量增加了8.4g.该混合气体可能是( )
|
| A. | 乙烷和乙烯 | B. | 乙烷和丙烯 | C. | 甲烷和乙烯 | D. | 甲烷和丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在2 L密闭容器内,800℃时NO(g)和O2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如表所示:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为________。
(2)下图中表示NO2变化曲线的是________,用O2表示从0~2 s内该反应的平均速率v=________。
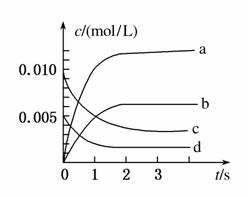
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
|
| A. | 常温常压下,1mol C2H4所含的电子数为12NA |
|
| B. | 标准状况下,16g甲烷中共价键数目为4NA |
|
| C. | 常温常压,4 g氦气所含的核外电子数为4NA |
|
| D. | 16g氧气和臭氧的混合物中含有1.5NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氢气在氯气中燃烧时产生苍白色火焰.在反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1mol氯气中的化学键消耗的能量为Q2kJ,形成1mol氯化氢中的化学键释放的能量为Q3kJ,则下列关系式中一定正确的是( )
|
| A. | Q1+Q2<2Q3 | B. | Q1+Q2>2Q3 | C. | Q1+Q2<Q3 | D. | Q1+Q2=Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在1LK2SO4和CuSO4的混合溶液中,c(SO42﹣)=2.0mol•L﹣1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标况)气体,则原溶液中K+的物质的量浓度为( )
|
| A. | 2.0mol•L﹣1 | B. | 1.5mol•L﹣1 | C. | 1.0mol•L﹣1 | D. | 0.5mol•L﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32﹣)、c(HCO3﹣)都减少,其方法是( )
|
| A. | 通入二氧化碳气体 | B. | 加入氢氧化钠固体 |
|
| C. | 通入氯化氢气体 | D. | 加入饱和石灰水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
|
| A. | 加热 |
|
| B. | 不用稀硫酸,改用98%的浓硫酸 |
|
| C. | 滴加少量CuSO4溶液 |
|
| D. | 不用铁片,改用铁粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com