
【题目】(15分)(1)氯化铝水溶液呈 性,原因是(用离子方程式表示):
。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 ,Al2(SO4)3溶液蒸干最后得到的固体产物是 ;
(2)NaHCO3的水溶液呈 (填“酸”、“中”或“碱”)性,实验室保存NaHCO3溶液的试剂瓶应用 塞,原因是 (写出有关的离子方程式);
(3)普通泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是 。
(4)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水。
①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) ;④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号) 。
【答案】(1)酸 Al3+ + 3H2O![]() Al(OH)3+ 3H+ Al2O3 Al2(SO4)3
Al(OH)3+ 3H+ Al2O3 Al2(SO4)3
(2)碱 橡皮 HCO![]() + H2O
+ H2O![]() H2CO3 + OH— 2OH— +SiO2 = SiO2
H2CO3 + OH— 2OH— +SiO2 = SiO2![]() + H2O
+ H2O
(3)3HCO![]() + Al3+ = Al(OH)3↓+ 3CO2↑
+ Al3+ = Al(OH)3↓+ 3CO2↑
(4)④、②、③、① ; ⑥、⑦、④、⑤、⑧
【解析】
试题(1)氯化铝是强酸弱碱盐,水解显酸性,方程式为Al3+ + 3H2O![]() Al(OH)3+ 3H+ ;由于水解是吸热的,所以升高温度,促进水解,且氯化氢极易挥发,所以最终得到的是氢氧化铝,灼烧得到氧化铝。由于硫酸是难挥发性的,所以将硫酸铝溶液蒸干,得到的是Al2(SO4)3。
Al(OH)3+ 3H+ ;由于水解是吸热的,所以升高温度,促进水解,且氯化氢极易挥发,所以最终得到的是氢氧化铝,灼烧得到氧化铝。由于硫酸是难挥发性的,所以将硫酸铝溶液蒸干,得到的是Al2(SO4)3。
(2)碳酸氢钠由于水解程度大于电离程度,所以溶液显碱性。由于碱能和玻璃中的二氧化硅反应生成黏性强的硅酸钠,而使瓶塞和瓶口打不开,所以应该用橡皮塞。方程式分别为
HCO3-+H2O![]() H2CO3+OH-、2OH-+SiO2=SiO32-+H2O。
H2CO3+OH-、2OH-+SiO2=SiO32-+H2O。
(3)碳酸氢钠和硫酸铝水解相互促进,生成氢氧化铝和CO2,方程式为3HCO3-+Al3+=Al(OH)3↓+3CO2↑。
(4)酸或碱的溶液中氢离子浓度或OH-浓度越大,对水的抑制程度越大。硫酸是二元强酸,氢氧化钠是一元强碱,醋酸是弱酸,氯化铵水解促进水的电离,所以①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是④、②、③、①;醋酸根水解显碱性,促进NH4+水解。磷酸氢铵难电离出氢离子,抑制NH4+水解。氨水是弱碱,所以④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是⑥、⑦、④、⑤、⑧。
考点;考查盐类水解的应用


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】新华社报道:全国农村应当在“绿色生态·美丽多彩·低碳节能·循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃、101 kPa时:
①C(s)+O2(g)===CO(g) ΔH=-126.4 kJ/mol
②2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol
③H2O(g)===H2O(l) ΔH=-44 kJ/mol
则在25℃、101kPa时:
C(s)+H2O(g)===CO(g)+H2(g) ΔH=________。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g) ![]() Fe(s)+CO2(g) ΔH>0
Fe(s)+CO2(g) ΔH>0
已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值________(填“增大”“减小”或“不变”)。
②1 100℃时测得高炉中,c(CO2)=0.025 mol/L,c(CO)=0.1 mol/L,则在这种情况下,该反应是否处于化学平衡状态?________(填“是”或“否”),其判断依据是______________________。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。
现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如下图所示。
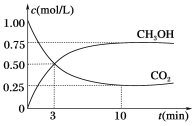
①从反应开始到平衡,氢气的平均反应速率v(H2)=________。
②下列措施能使![]() 增大的是______(填字母)。
增大的是______(填字母)。
A.升高温度 B.再充入H2 C.再充入CO2
D.将H2O(g)从体系中分离 E.充入He(g),使体系压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) ![]() 2NO2(g) ΔH,随温度升高,混合气体的颜色变深。
2NO2(g) ΔH,随温度升高,混合气体的颜色变深。
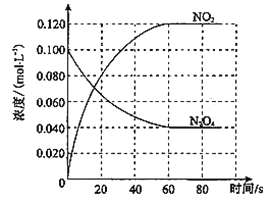
回答下列问题:
(1)反应的ΔH_____0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,平均反应速率v(NO2)为________molL-1s-1,反应的平衡常数K为(数值)__________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4) 以0.0020 molL-1s-1的平均速率降低,经10 s又达到平衡。则T__________100℃(填“大于”或“小于”)。
(3)利用图(a)和(b)中的信息,按图(b)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是__________________ 。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制玻璃主要原料有石英、纯碱和石灰石.在玻璃窑中发生主要反应的化学方程式为:①Na2CO3+SiO2![]() Na2SiO3+CO2↑;②CaCO3+SiO2
Na2SiO3+CO2↑;②CaCO3+SiO2![]() CaSiO3+CO2↑。
CaSiO3+CO2↑。
(1)反应①中,被破坏的微粒间的作用力有__________(选填编号)。
a. 范德华力 b. 离子键 c. 共价键
(2)上述两个反应的反应物和生成物中,涉及到的不同类型的晶体有____种(填数字),其中熔沸点最低的化合物的电子式为___;该化合物熔沸点低于CS2的原因是____。
(3)纯碱中的金属阳离子的半径比铝离子半径______(填“大”或“小”);石灰石中的金属阳离子的电子所占据的电子层中,能量最高的是___层(填“电子层符号”)。
(4)已知10 g碳酸钙完全分解,共吸收17.56 KJ的热量,写出该反应的热化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。实验步骤如下:①连接好实验装置,检查装置的气密性。②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。③加热,开始反应,直到不再有气体产生为止。④排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为278.8 mL。⑤准确称量试管和残留物的质量为15. 55 g。

根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?________。
(2)进行步骤的④实验操作时,若仰视读数,则读取氧气的体积_____(填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是__mol(保留小数点后四位);实验测得氧气的气体摩尔体积是__(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.4g氨气中所含NH3分子数为 _____,所含氢原子个数为 ______,标准状况下的体积为_____L,所含电子的物质的量为 _____ mol,将其溶于水配成200mL溶液,其物质的量浓度为___ mol/L。
(2)32克某气体含有6.02×1023个气体分子,则该气体的摩尔质量为 _____。
(3)标准状况下有①6.72LCH4 ②3.01×1023个HCl分子③13.6g H2S气体④0.2molNH3,体积最大的是___,密度最小的是___,质量最小的是__(填序号)。
(4)用等体积的0.1 mol·L-1的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中的SO42- 都恰好完全沉淀,则三种硫酸盐的物质的量浓度之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品香精菠萝酯的生产路线(反应条件略去)如下:
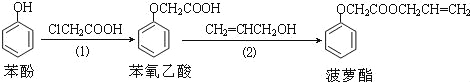
下列叙述错误的是( )
A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
C.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
D.步骤(2)产物中残留的丙烯醇可用溴水检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)在工业上用于橡胶的硫化,还可以作为贵金属的萃取剂。可由硫和氯气在100~110 ℃直接化合而成。实验室用以下装置制备S2Cl2并对尾气进行回收利用。已知S2Cl2的熔点:-77 ℃,沸点:137 ℃,S2Cl2遇水剧烈反应。
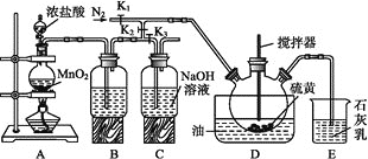
(1)S2Cl2遇水会生成黄色单质、一种能使品红溶液褪色的气体化合物及酸雾,写出该反应的化学方程式__________________________________。
(2)B中所装试剂名称为__________________________。
(3)A、B装置中的空气可以通过控制K2、K3来去除,具体方法为_________。
(4)装置E的作用是____________________________________________,写出E中发生的氧化还原反应的化学方程式_________________________。
(5)实验时,D装置开始需要油浴加热一段时间,之后停止加热,仅需通入氯气即可。生成二氯化二硫的反应为________ (填“放热”或“吸热”)反应。
(6)该装置由于存在系统缺陷,使制得的二氯化二硫可能不纯,现需对该装置进行改进,则改进的方法为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol CH4和适量O2在密闭容器中混合点燃,充分反应后CH4和O2均无剩余,且产物均为气体,质量为72 g。下列叙述正确的是
A. 若将产物通过碱石灰,则可全部被吸收;若通入浓硫酸,则不能完全被吸收
B. 产物的平均摩尔质量为20 g·mol-1
C. 若将产物通过浓硫酸后恢复至室温,压强变为原来的1/2
D. 反应中消耗O256 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com