
| A. | 分别加入足量锌片,两种溶液生成H2的体积相同 | |
| B. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| C. | 醋酸中的c(CH3COO-)和硫酸中的c(SO${\;}_{4}^{2-}$)相等 | |
| D. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 |
分析 A、硫酸是强电解质,完全电离,醋酸是弱电解质,溶液中主要以醋酸分子存在,与足量的锌反应,醋酸提供的氢离子远远大于硫酸;
B、醋酸加水稀释电离出氢离子,而硫酸氢离子的浓度减小;
C、根据电荷可知,醋酸溶液中c(H+)=c(CH3COO-),硫酸溶液中c(H+)=2c(SO42-),据此判断;
D、pH均为3的醋酸和硫酸,溶液中氢离子浓度为1×10-3mol/L,根据Kw=c(H+)•c(OH-)计算溶液中c(OH-),溶液中水电离出的氢离子浓度等于溶液中氢氧根离子的浓度;
解答 解:A、硫酸是强电解质,完全电离,醋酸是弱电解质,溶液中主要以醋酸分子存在,与足量的锌反应,体积相同、pH相同的醋酸提供的氢离子远远大于硫酸,锌与醋酸反应产生的氢气原大于与硫酸反应生成的氢气,故A错误;
B、醋酸是弱电解质,加水稀释促进电离,加水稀释100倍后,硫酸的pH=5,而醋酸的pH小于5,所以分别加水稀释100倍后,两种溶液的pH不相同,故B错误;
C、根据电荷可知,醋酸溶液中c(H+)=c(CH3COO-)=1×10-3mol/L,硫酸溶液中c(H+)=2c(SO42-)=1×10-3mol/L,故c(SO42-)=5×10-4mol/L,故C错误;
D、pH均为3的醋酸和硫酸,溶液中氢离子浓度均为1×10-3mol/L,溶液中氢氧根浓度均为c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-3}}$=1×10-11mol/L,溶液中水电离出的氢离子浓度等于溶液中氢氧根离子的浓度,故两种溶液中,由水电离出的氢离子浓度均为1×10-11mol•L-1,故D正确;
故选D.
点评 考查弱电解质的电离、溶液pH的有关计算等,难度不大,注意弱电解质的电离存在平衡,电离程度很小.


科目:高中化学 来源: 题型:选择题
| A. | 强电解质的水溶液中不存在分子 | |
| B. | 纯水和干木头都不导电,但木头用水浸湿后却可以导电 | |
| C. | 某溶液的PH=7,该溶液一定呈中性 | |
| D. | 不溶性盐都是弱电解质,可溶性酸和强碱都是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2O(g)△H=+267kJ/mol | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-534kJ/mol | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534kJ/mol | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2912 kJ | B. | 3236 kJ | C. | 2953 kJ | D. | 3867 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃氢气等易燃性气体前,必须检验气体的纯度 | |
| B. | 用嘴吹灭酒精灯火焰 | |
| C. | 加热试管里的液体时,试管口对着他人 | |
| D. | 把水注入浓硫酸中进行稀释 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
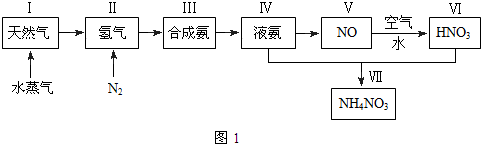
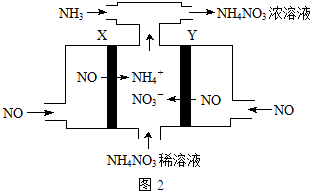
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
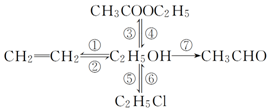 写出下列各物质相互转化的化学方程式,并说明各步的反应类型.
写出下列各物质相互转化的化学方程式,并说明各步的反应类型.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com