
【题目】铜是一种重要的战略物资,以黄铜矿(主要成分是CuFeS2)为主要原料生产铜、铁红、单质硫时,原料的综合利用率较高,其主要流程如图所示(已知Na[CuCl2]的电离方程式为:Na[CuCl2]=Na++[CuCl2]-):
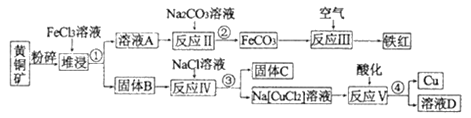
(1)操作①、②、③、④的目的相同,在实验中这种操作的名称是____________。铁红的重要用途:_______________(写其中一种)。
(2)流程中粉碎的目的是______________________________________。
(3)固体B中含有两种产物,一种是单质C,另一种是原子个数比为1:1 的一种金属的低价态盐,写出堆浸时反应的化学方程式:______________________________________。
(4)反应V的离子方程式:______________________________________。
(5)此方法中得到的铜纯度不能满足某些生产的需要,需要利用电解法进行提纯。若用如下图所示的装置进行电解精炼, e电极上的电极反应式为____________________________________。

若当电路中有2mol电子通过时,乙中某个电极质量减轻了63.92g,则粗铜的纯度为(假设杂质只有铁且精炼时铜与铁的放电比例与混合物的物质的量之比相同,计算时用%表示保留一位小数)_______________。
【答案】过滤 红色油漆、涂料、炼铁原料等(写其中一个) 增大反应物间的接触面积,加快反应速率,使反应更充分 CuFeS2+3FeCl3=4FeCl2+CuCl↓+2S↓ 2[CuCl2]ˉ=Cu+Cu2++4Clˉ Cu2++2eˉ=Cu 99.1%
【解析】
(1)根据流程图,操作①、②、③、④的目的是分离出固体和溶液,操作名称为过滤;铁红的成分是Fe2O3,其用途为红色油漆、涂料、炼铁原料等;
(2)将黄铜矿矿石粉碎,在堆浸过程中,增大接触面积,有利于反应充分,加快反应速率;
(3)根据信息“以黄铜矿为主要原料生产铜、铁红、单质硫”,结合流程图可知固体C是单质硫,另一种是原子个数比为1:1的一种金属的低价态盐,根据元素可知该低价态盐为CuCl,反应II生成FeCO3,说明溶液A中含有Fe2+,因此堆浸的化学反应方程式为CuFeS2+3FeCl3=4FeCl2+CuCl↓+2S↓;
(4)[CuCl2]-中Cu显+1价,反应V中酸化,+1价Cu发生歧化反应,生成Cu和Cu2+,即反应V的离子方程式为2[CuCl2]-=Cu+Cu2++4Cl-;
(5)甲装置为原电池,乙装置为电解池,通燃料的一极为负极,通氧气的一极为正极,即a为正极,b为负极,根据电解原理,e电极为阴极,d为阳极,阴极反应式为Cu2++2e-=Cu,乙中某电极质量减少,即阳极质量减少,其电极反应式为Fe-2e-=Fe2+、Cu-2e-=Cu2+,设铜的物质的量为xmol,铁的物质的量为ymol,即有2x+2y=2,64x+56y=63.92,解得x=0.99,y=0.01,因此粗铜的纯度为![]() ×100%=99.1%。
×100%=99.1%。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】某研究小组设计如下装置处理pH为5-6的污水。下列说法正确的是

A. 阳极的电极反应式为:Fe-3e-=Fe3+
B. 正极的电极反应式为:O2+2H2O+4e-=4OH-
C. 若阴极转移2mol电子,则负极消耗5.6LCH4
D. 污水中最终会产生Fe(OH)3,吸附污物而形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图装置中,烧瓶中充满干燥气体 a,将滴管中的液体 b 挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹 f,烧杯中的液体 b 呈喷泉状喷出,最终几乎充满烧瓶。则 a 和 b 分别是
a(干燥气体) | b(液体) |
| |
A | NO2 | 水 | |
B | CO2 | 4 mol·L-1 NaOH 溶液 | |
C | Cl2 | 饱和 NaCl 溶液 | |
D | N2 | 1 mol·L-1 盐酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol/L盐酸滴入20.00 mL 1.000 mo1/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是( )

A. a点由水电离出的c(H+) = 1.0 × 10-14 mo1/L
B. b点:c(NH4+) > c(Cl-) > c(OH-) > c(H+)
C. c点:盐酸与氨水恰好完全反应
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯水合法合成乙醇分两步完成,反应过程中的能量变化如图所示,对于在密闭容器中进行的合成反应,下列说法不正确的是

A.反应①和反应②均为放热反应
B.反应①为加成反应,反应②为取代反应
C.硫酸是该反应的催化剂
D.总的能量变化为(E1+E2-E3-E4)kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是

A. Ksp〔Fe(OH)3〕<Ksp〔Cu(OH)2〕
B. 加适量浓NH3·H2O可使溶液由a 点变到b点
C. c、d两点代表的溶液中c(H+) 与c(OH-)乘积不相等
D. Fe(OH)3在d点代表的溶液过饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室常用的气体制备、净化和收集装置。若依据反应H2C2O4 CO↑+CO2↑+H2O制取CO,则合理的装置组合为( )
CO↑+CO2↑+H2O制取CO,则合理的装置组合为( )

A. ①⑤⑧B. ③⑤⑦C. ②⑤⑥D. ③④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各实验装置的叙述中,不正确的是

A. 装置①可用于实验室制取少量NH3或O2
B. 可用从a处加水的方法检验装置②的气密性
C. 实验室不可用装置③收集HCl
D. 验证溴乙烷发生消去反应生成烯烃的实验可利用装置④进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com