
【题目】
汽车尾气中的氮氧化物气体是导致雾霾的要原因之一。请回答下列有关尾气治理的问题:
(1)用化学方程式解释汽车尾气中含有NO的原因_______________________________。
(2)汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物NO、CO转化为无毒的大气循环物质。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJmol-1
2C(s)+O2(g)=2CO(g) △H= -221.0kJmol-1
C(s)+O2(g)=CO2(g) △H= -393.5 kJmol-1
则分析反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H= ___________kJmol-1。
(3)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中,在不同条件下反应过程中部分物质的浓度变化状况如图1所示。
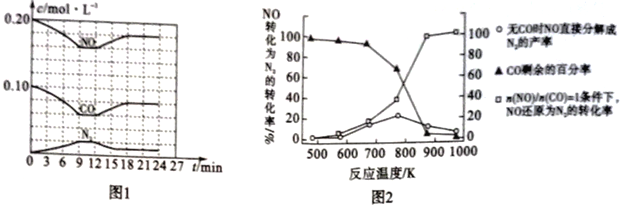
①计算反应在第9-12 min时的平衡常数K=____________。
②第12 min时改变的反应条件可能是_____________(任写一条)。
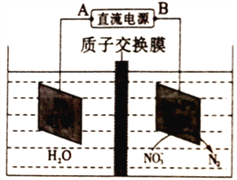
(4)某研究机构在实验室以Ag-ZSM-5为催化剂。测得单位时间内NO转化为N2的转化率随温度变化情况如图2所示。
①若不使用CO,发现当温度超过775 K时,NO的分解率降低,其可能的原因是________________。
②在n(NO)/n(CO) =1的条件下,为更好地除去NO,应控制的最佳温度应在____ K左右。
(5)氮氧化物进入水体可转化为NO3-,电化学降解法可用于治理水中NO3-的污染,原理如右图所示。则电源正极为______(选填“A”或“B”),阴极电极反应式为__________________。
【答案】 N2 + O2 ![]() 2NO —746.5 0.35(或
2NO —746.5 0.35(或![]() ) 温度升高 NO的分解反应是放热反应,升高温度不利于反应进行 870K(只要在850-900K均可) A 2NO3-+10e-+12H+==N2↑+6H2O
) 温度升高 NO的分解反应是放热反应,升高温度不利于反应进行 870K(只要在850-900K均可) A 2NO3-+10e-+12H+==N2↑+6H2O
【解析】试题分析:(1)氮气与氧气在高温、放电条件下生成NO;(2)根据盖斯定律计算2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H;(3)①根据![]() 计算9-12 min时的平衡常数;②根据图1,第12 min时NO、CO浓度增大、N2浓度减小,平衡逆向移动;(4)①NO的分解反应是放热反应,升高温度不利于反应进行;②n(NO)/n(CO) =1的条件下,850-900K时NO转化为N2的转化率几乎达到100%;(5)根据图示,右池中NO3-发生还原反应生成氮气,所以右池是阴极,阴极NO3-得电子生成氮气;
计算9-12 min时的平衡常数;②根据图1,第12 min时NO、CO浓度增大、N2浓度减小,平衡逆向移动;(4)①NO的分解反应是放热反应,升高温度不利于反应进行;②n(NO)/n(CO) =1的条件下,850-900K时NO转化为N2的转化率几乎达到100%;(5)根据图示,右池中NO3-发生还原反应生成氮气,所以右池是阴极,阴极NO3-得电子生成氮气;
解析:(1)氮气与氧气在高温、放电条件下生成NO,反应方程式是N2 + O2 ![]() 2NO;(2)①N2(g)+O2(g)=2NO(g) △H=+180.5kJmol-1;②2C(s)+O2(g)=2CO (g) △H= -221.0kJmol-1;③C(s)+O2(g)=CO2(g) △H= -393.5 kJmol-1,根据盖斯定律③×2-①-②得2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H= —746.5 kJmol-1;(3)①9-12 min时c(NO)=0.16mol/L、c(CO)=0.06 mol/L、c(N2)=0.02 mol/L、c(CO2)=0.04 mol/L,
2NO;(2)①N2(g)+O2(g)=2NO(g) △H=+180.5kJmol-1;②2C(s)+O2(g)=2CO (g) △H= -221.0kJmol-1;③C(s)+O2(g)=CO2(g) △H= -393.5 kJmol-1,根据盖斯定律③×2-①-②得2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H= —746.5 kJmol-1;(3)①9-12 min时c(NO)=0.16mol/L、c(CO)=0.06 mol/L、c(N2)=0.02 mol/L、c(CO2)=0.04 mol/L,![]() 0.35;②根据图1,第12 min时NO、CO浓度增大、N2浓度减小,平衡逆向移动,所以改变的条件可能是升高温度;(4)①NO的分解反应是放热反应,升高温度不利于反应进行,所以当温度超过775 K时,NO的分解率降低;②n(NO)/n(CO) =1的条件下,850-900K时NO转化为N2的转化率几乎达到100%,为更好地除去NO,应控制的最佳温度应在870K左右;(5)根据图示,右池中NO3-发生还原反应生成氮气,所以右池是阴极,B是电源负极、A是电源正极,阴极NO3-得电子生成氮气,电极反应为2NO3-+10e-+12H+==N2↑+6H2O;
0.35;②根据图1,第12 min时NO、CO浓度增大、N2浓度减小,平衡逆向移动,所以改变的条件可能是升高温度;(4)①NO的分解反应是放热反应,升高温度不利于反应进行,所以当温度超过775 K时,NO的分解率降低;②n(NO)/n(CO) =1的条件下,850-900K时NO转化为N2的转化率几乎达到100%,为更好地除去NO,应控制的最佳温度应在870K左右;(5)根据图示,右池中NO3-发生还原反应生成氮气,所以右池是阴极,B是电源负极、A是电源正极,阴极NO3-得电子生成氮气,电极反应为2NO3-+10e-+12H+==N2↑+6H2O;


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知:NOx能与Na2O2反应;NO和NO2均能与酸性KMnO4溶液反应生成NO3ˉ和Mn2+。
I.用下图所示装置(略去夹持仪器)可制得少量亚硝酸钠(2NO+Na2O2=2NaNO2)。

(1)B、D的仪器名称是________,D的作用是________。
(2)通NO前,需先通一段时间N2,目的是________,
(3)E中主要反应的离子方程式为________,
(4)常温下,测得实验前后C的质量差值为0.30g,则制得NaNO2________g。
Ⅱ.NO2和Na2O2都有较强氧化性,为探究NO2与Na2O2反应的产物,提出如下假设:
假设i.NO2氧化Na2O2;假设ii.Na2O2氧化NO2。
甲同学设计如图所示实验装置:

请回答下列问题:
(5)单向阀在实现气体单向流通的同时,还有一个作用是___________。
(6)待试管G中收集满气体,向试管G中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃,甲同学据此认为假设i正确。乙同学认为该装置不能达到实验目的,为达到实验目的,应在F、G之间增加一个M装置,M中应盛装__________(可供选择的试剂:碱石灰,浓硫酸饱和氯化钠溶液);乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条未复燃。得到结论:假设ⅱ正确。
请做出正确判断,写出NO2和Na2O2反应的化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产需要大量原料,消耗大量能源,在得到所需产品同时产生了大量废气、废水、废渣。某工厂排放的废水中含有Cu2+、Fe2+、Hg2+、H+等离子,某化学小组为了充分利用资源和保护环境,准备回收废水中的铜和汞,同时得到绿矾。他们设计了如下实验方案:

(1)现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等,完成步骤Ⅳ的实验操作还需要选择的玻璃仪器是__________设计简单实验检验绿矾是否变质,简述你的操作:__________。
(2)步骤Ⅰ中加入过量铁粉的目的是__________,步骤Ⅱ中__________(填“能”或“不能”)用盐酸代替硫酸。
(3)步骤V利用氧化铜制取铜有如下四种方案:
方案甲:利用氢气还原氧化铜;
方案乙:利用一氧化碳还原氧化铜;
方案丙:利用炭粉还原氧化铜;
方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉、过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。
从安全角度考虑,方案__________不好;从产品纯度考虑,方案__________不好。
(4)写出步骤Ⅱ中涉及反应的离子方程式:__________;步骤Ⅳ得到绿矾的操作蒸发浓缩__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于阿伏加德罗常数的叙述错误的是
A.物质的量越大,阿伏加德罗常数就越大
B.1mol任何粒子的数目都约等于6.02×1023
C.符号为NA,通常用6.02×1023mol-1表示
D.在数值上等于12g12C中所含的碳原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )

A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语使用正确的是
A. 硫原子的原子结构示意图: 
B. 原子核内有10个中子的氧原子:![]()
C. NH4Cl的电子式:  .
.
D. 次氯酸的结构式:H-Cl-O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)═2AB(s)的能量变化如图所示,判断下列叙述中错误的是( )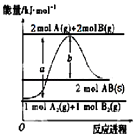
A.该反应热△H=+(a﹣b)kJmol﹣1
B.AB(g)═A(g)+B(g)△H=+b/2kJmol﹣1
C.断裂1 mol A﹣A键和1 mol B﹣B键,吸收a kJ能量
D.该反应在任何条件下都不可能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大。Z在短周期主族元素中原子半径最大;m、n、p、q为它们的单质;常温下,q为黄绿色气体,a为无色液体;各物质间转化关系如图所示。下列说法不正确的是

A. d中可能含有非极性共价键
B. Y、Z、W分别与X形成的化合物沸点:Z<Y<W
C. m在q中燃烧,产生大量白雾
D. 元素非金属性:Y>W>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com