
| A. | 凡是放热反应的发生均无需加热 | |
| B. | 物质发生化学反应都伴随着能量变化 | |
| C. | 凡是需要加热后才能发生的反应是吸热反应 | |
| D. | 伴有能量变化的物质变化都是化学变化 |
分析 A.反应放热还是吸热与反应条件无关,决定于反应物与生成物的能量差;
B.化学变化是旧键断裂新键形成的过程,断键成键都有能量变化;
C.反应放热还是吸热与反应条件无关,决定于反应物与生成物的能量差;
D.物质的三态变化有能量变化,是物理变化.
解答 解:A.燃烧都是放热的但需加热到着火点,故A错误;
B.化学变化是旧键断裂新键形成的过程,断键成键都有能量变化,故B正确.
C.燃烧都是放热的但需加热到着火点,铝热剂需要加热才能发生反应,故C错误;
D.物质的三态变化有能量变化,是物理变化,故D错误;
故选B.
点评 本题考查反应热与反应条件无关,只决定于反应物和生成物的能量高低,同时考查了化学反应中能量变化的原因,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| KMnO4酸性溶液 的浓度/mol•L-1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 12 |
| 0.001 | 6 | 7 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
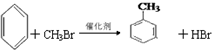 ;②C物质苯环上一卤代物只有两种.
;②C物质苯环上一卤代物只有两种.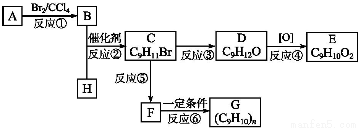
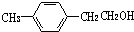 ,F的分子式C9H10.
,F的分子式C9H10.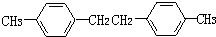 .
.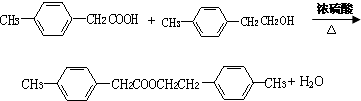 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在外加电场的作用下,胶体发生电泳现象,说明胶体是带电荷的 | |
| B. | 水的沸点比硫化氢的沸点高,是因为水分子内形成了氢键 | |
| C. | 晶体中有阴离子就一定有阳离子 | |
| D. | 有单质参加或生成的反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu具有相同的最外层电子数 | |
| C. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu具有相同的中子数 | |
| D. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U具有完全相同的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:
X、Y、Z、W四种短周期元素在周期表中的位置关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子内层电子数是其最外层电子数的三分之一 |
| Y | 在第三周期元素中,Y的简单离子半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com