
分析 依据纯水存在电离平衡,电离出的氢离子浓度和氢氧根离子浓度相同;在酸溶液、碱溶液、盐溶液中存在离子积常数,Kw随温度变化;依据离子积计算离子浓度;
解答 解:某温度下纯水中的C(H+)=3.0×10-7mol/L,则此时溶液中的C(OH-)=3.0×10-7mol/L;若温度不变,滴入稀硫酸,使C(H+)=5.0×10-6mol/L,该温度下溶液中则溶液中C(H+)C(OH-)=9.0×10-14,C(OH-)=$\frac{9.0×1{0}^{-14}}{5.0×1{0}^{-6}}$=1.8×10-8mol/L,
故答案为:3.0×10-7mol/L;1.8×10-8mol/L;
点评 本题考查了水的离子积应用,溶液中离子积的计算判断,题目较简单.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | NH5是共价化合物 | |
| B. | NH5的电子式为NH4+[:H]- | |
| C. | NH5中氢元素呈价+1和-1价 | |
| D. | NH5与水发生氧化还原反应,置换出氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
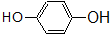 ③
③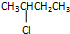
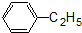 ⑤
⑤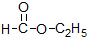 ⑥
⑥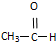
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | VII | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ | (11) |
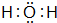 ;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑
;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下某CH3COONa溶液的pH=8 | |
| B. | 用CH3COOH溶液做导电实验,灯泡很暗 | |
| C. | 等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多 | |
| D. | CH3COONa和H3PO4反应,生成CH3COOH. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -16Q kJ/mol | B. | +8Q kJ/mol | C. | +16 Q kJ/mol | D. | -8 Q kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 B.
B. C.甲醇 D.CH3-O-CH3E.HO-CH2CH2-OH
C.甲醇 D.CH3-O-CH3E.HO-CH2CH2-OH查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com