
| A. | 氨水使湿润的红色石蕊试纸变蓝:NH3•H2O?NH4++OH- | |
| B. | 工业上用过量的NaOH溶液吸收:SO2:SO2+OH-=HSO3- | |
| C. | 用烧碱溶液清洗铝表面的氧化膜:2OH-+Al2O3=2AlO2-+H2O | |
| D. | 用石灰乳吸收泄露的氯气:Ca(OH)2+Cl2=Ca2++Cl-+ClO-+H2O |
分析 A.一水合氨为弱电解质,部分电离;
B.二氧化硫少量反应生成亚硫酸钠;
C.氢氧化钠与氧化铝反应生成偏铝酸钠和水;
D.氯离子书写错误.
解答 解:A.氨水使湿润的红色石蕊试纸变蓝,一水合氨电离方程式:NH3•H2O?NH4++OH-,故A正确;
B.工业上用过量的NaOH溶液吸收:SO2:SO2+2OH-=H2O+SO32-,故B错误;
C.氧化铝为两性氧化物,能够与氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为2OH-+Al2O3═2AlO2-+H2O,故C正确;
D.用石灰乳吸收泄露的氯气:Ca(OH)2+Cl2=Ca2++Cl-+ClO-+H2O,故D正确;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分,题目难度不大.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:选择题
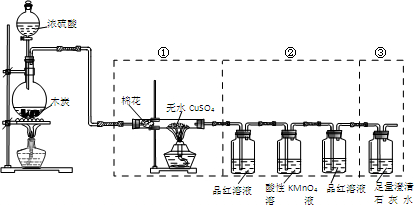
| A. | 实验时可观察到装置①中白色硫酸铜粉末变蓝色 | |
| B. | 装置②中前后两次观察到品红溶液的现象应不相同 | |
| C. | 装置③用于检验产物中二氧化碳气体的生成 | |
| D. | 如果将仪器的连接顺序变为②③①,同样可以检出所有气体产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | A | NaCl | KCl | CaCl2 |
| 熔点(K) | 1074 | 918 | ||
| 物质 | B | Na | Mg | Al |
| 熔点(K) | 317 | 923 | 933 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
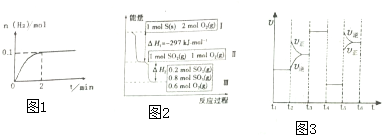
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | |
| B. | 10mol•L-1的浓氨水:Al3+、NH4+、NO3-、I- | |
| C. | 0.1mol•L-1KMnO4溶液:Na+、Fe2+、SO42-、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
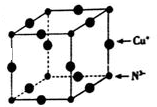 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
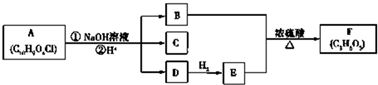
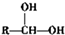 $\stackrel{自动脱水}{→}$
$\stackrel{自动脱水}{→}$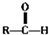 (R为羟基)
(R为羟基) .
. .
.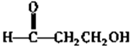 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com