
����Ŀ����֪4NH3��g��+5O2��g��4NO��g��+6H2O��g����H��0�������й�������ȷ�ģ� ��
A.������Ӧ�Ļ�ѧ��Ӧ���ʹ�ϵ��2 v��NH3��=3 v��H2O��
B.����2L���ܱ������з�Ӧ������3min��NH3�����ʵ�����10mol��Ϊ7mol��v ��NH3��=0.5molL��1s��1
C.�ﵽ��ѧƽ��ʱ�����������������������Ӧ���ʼ�С���淴Ӧ��������
D.�������¶ȣ���Ӧ���ʽ����С
���𰸡�D
���������⣺A����ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ�ӦΪ3 v��NH3��=2 v��H2O������A����B��v= ![]() =
= ![]() =0.5molL��1min��1 �� ��Ŀ��λ����B����
=0.5molL��1min��1 �� ��Ŀ��λ����B����
C���������������ѹǿ��С�����淴Ӧ���ʶ���С����C����
D�������¶ȣ���Ӧ���ʼ�С����D��ȷ��
��ѡD��
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���ʼ����������֪ʶ�����ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����


 ����������������ϵ�д�
����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯����BaI22H2O����һ�ְ�ɫ��ĩ����������ȡ�������⻯���һ���Ʊ�������ͼ1�� 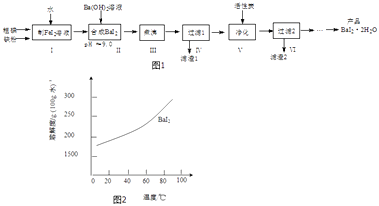
��1���������FeI2��Һʱ����߷�Ӧ���ʵĿ��д�ʩ��������ţ���
a�����ۺ͵������ĥ��ĥ��ϸ��
b������n�����ۣ���n���⣩�����ϱ�
c���ʵ����߷�Ӧ�¶Ⱥͽ����ٶ�
d����Ӧ���м�ˮ��I2ȫ���ܽ�
��2�����������Ӧ�Ļ�ѧ����ʽΪ����pH��ֽ�ⶨ��ҺpH�ķ�����
��3�������С�ġ���С�Լ20���ӣ���ʹFe��OH��2����������Ŀ����������V�������̿��Ŀ���� ��
��4���ӹ���2������Һ�л��BaI22H2O���ܽ��������ͼ2��ʾ���ķ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.�ǽ���Ԫ��R���γɵĺ�������(MaROb)�е�RԪ�رض���������
B.ֻ�зǽ������γɺ������������
C.��ϡ��������ķǽ���Ԫ�ض������ɲ�ͬ��̬�ĺ�����
D.�ǽ�������ۺ����ᶼ����ǿ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£��������ʲ�����������跴Ӧ���ǣ� ��
�ٽ�̿ �ڴ��� ��̼��� ������� ������ ���������� ����������
A.�ۢݢ�B.�ݢ�C.�ۢ�D.��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ����������£�����ѡ����ʾ�����ʼ�ת������ʵ�ֵ��ǣ� ��
A.NH3 ![]() NO
NO ![]() NaNO2
NaNO2
B.Fe2O3 ![]() Fe
Fe ![]() FeCl3
FeCl3
C.SiO2 ![]() H2SiO3��aq��
H2SiO3��aq�� ![]() Na2SiO3
Na2SiO3
D.CuCl2��aq�� ![]() Cu��OH��2
Cu��OH��2 ![]() Cu2O
Cu2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к��� HCO3����SO32����CO32����CH3COO���� 4 �������ӡ��������м���������Na2O2 ����Һ������Ũ�ȱ仯��С����( )
A. CO32�� B. SO32�� C. CH3COO�� D. HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���ѧ��Ӧ2H2+O2�T2H2O�������仯��ͼ��ʾ����Ӧ���Ȼ�ѧ����ʽ�ɱ�ʾΪ�� �� 
A.H2��g��+ ![]() ?O2��g���TH2O��g����H=��a+b�� kJ?mol��1
?O2��g���TH2O��g����H=��a+b�� kJ?mol��1
B.2H2��g��+O2��g���T2H2O��g����H=2��b��a�� kJ?mol��1
C.H2��g��+ ![]() ?O2��g���TH2O��l����H=��b+c��a�� kJ?mol��1
?O2��g���TH2O��l����H=��b+c��a�� kJ?mol��1
D.2H2��g��+O2��g���T2H2O��l����H=2��a��b��c�� kJ?mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ˮ�е�ijЩ�ɷ�(����������)û�й�ϵ����
A. ��NaHCO3�������������ˮ������ɫ����(H��)
B. ʹ��ɫ������ɫ(HClO)
C. �μ�AgNO3��Һ���ɰ�ɫ����(Cl��)
D. ��FeCl2��Һ�еμ���ˮ���ٵμ�KSCN��Һ�����ֳʺ�ɫ(HCl)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʴ�йص�˵����ȷ����(����)

A. ͼa�������뺣ˮ�е�������Խ�����˸�ʴԽ����
B. ͼb����������M������Nʱ��Cu-Zn�Ͻ�ĸ�ʴ���ʼ�С
C. ͼc������ͨ����ʱZn��ʴ����������Zn�Ϸų����������Ҳ����
D. ͼd����Zn-MnO2�ɵ���Էŵ縯ʴ��Ҫ����MnO2���������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com