
将5mol/L盐酸10mL稀释到200mL,再取出5mL,这5mL溶液的物质的量浓度为
A.0.05mol/L B.0.25mol/L C.0.1mol/L D.0.5mol/L
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
冬季的降雪给机场和马路带来诸多不便,其中醋酸钾(CH3COOK)是融雪效果较好的融雪剂,下列关于醋酸钾说法正确的是
A.1 mol CH3COOK的质量为98 g·mol-1
B.CH3COOK的摩尔质量等于它的相对分子质量
C. 一个CH3COOK微粒的质量约为
一个CH3COOK微粒的质量约为 g
g
D.含有6.02×1023个碳原子的CH 3COOK的物质的量为1 mol
3COOK的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KOH溶液代替NaOH溶液 | B. | 用NaOH固体代替NaOH溶液 | ||
| C. | 反应物盐酸过量 | D. | 使用铜制搅拌棒搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
VL Fe2(S O4)3溶液中含有Fe3+ m g,则溶液中SO42﹣的物质的量浓度为
O4)3溶液中含有Fe3+ m g,则溶液中SO42﹣的物质的量浓度为
A.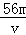 mol/L B.
mol/L B.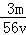 mol/L C.
mol/L C.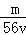 mol/L D.
mol/L D. mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加NaOH | B. | 加HCl | C. | 加NH4Cl | D. | 加同浓度的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2CO3溶液中加入甲酸无明显现象产生 | |
| B. | 25℃时,向甲酸中加入NaOH溶液,HCOOH的电离程度和K均增大 | |
| C. | 向碳酸中加入NaHCO3固体,c(H+)减小 | |
| D. | 向0.1 mol•L-1甲酸中加入蒸馏水,c(H+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用广泛pH试纸测得Na2CO3溶液的pH为10.5 | |
| B. | 用10mL量筒量取5.20mL盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用25mL的酸式滴定管量取14.80mL KMnO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com