
| 酸 | HX | HY | HZ |
| 电离常数K | 9×10-7 | 9×10-6 | 10-4 |
| A、三种酸的强弱关系:HX>HY>HZ |
| B、反应HZ+Y-═HY+Z-不能发生 |
| C、此温度下,1 mol/L HZ溶液的pH=2 |
| D、此温度下,1 mol/L HX溶液的电离常数大于0.1 mol/L HX |
| [H+]?[Z-] |
| [HZ] |
| [H+]2 |
| 1 |


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
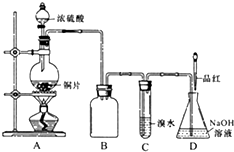 某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究.
某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究.| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 滴加少量淀粉碘化钾溶液,振荡 | Ⅲ | |
| ② | 滴加少量棕红色的KI3溶液,振荡 | Ⅱ | |
| ③ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②⑤ | C、①③ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 | B、2 | C、13 | D、14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 放电 |
| A、放电时,Na作正极,S极发生还原反应 |
| B、放电时,Na发生还原反应 |
| C、充电时,钠极与外电源的正极相连 |
| D、充电时,阳极发生的反应为:SX2--2e=xS |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子化合物中可能含有共价键 |
| B、极性分子中不含有非极性键 |
| C、非极性分子一定含有有非极性键 |
| D、共价化合物中可能含有含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该硫酸的物质的量浓度为9.2mol/L |
| B、常温下1mol铁与足量的该硫酸反应产生3g氢气 |
| C、配制500ml 4.6mol/l的稀硫酸需取该硫酸125ml |
| D、配制稀硫酸时,先向烧杯中加入浓硫酸,再沿玻璃棒慢慢加入适量水,且边加边搅拌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com