
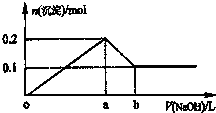
 在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,理论上,加入NaOH的体积和所得沉淀的物质的量的示意图如下,b处NaOH的体积为1L,则下列判断正确的是( )
在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,理论上,加入NaOH的体积和所得沉淀的物质的量的示意图如下,b处NaOH的体积为1L,则下列判断正确的是( )| A、混合溶液中Al3+的物质的量为0.1mol |
| B、NaOH的浓度为0.5 mol/L |
| C、在b点处溶液中的溶质只有NaAlO2 |
| D、图中线段oa:ab=4:1 |
| 0.6mol |
| 1L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、N2和CO |
| B、H2和CO |
| C、CH4 |
| D、H2和CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能I(eV) | A | B | C | D | E |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 153.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、藻类大量繁殖,抢走了鱼类的营养 |
| B、水中缺氧,窒息而死 |
| C、水中氧气过多 |
| D、水中含有有毒的金属元素过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲酸、乙醛、甲酸钠溶液、乙酸乙酯 |
| B、丙烯、甲烷、乙炔、乙烯 |
| C、苯酚、乙醇、苯、四氯化碳 |
| D、苯乙烯、苯酚、乙苯、二甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、分子式为C15H26O |
| B、既能发生取代反应,也能发生加成反应 |
| C、1mo1橙花醇在氧气中充分燃烧,需消耗470.4L氧气(标准状况) |
| D、1mo1橙花醇在室温下与溴四氯化碳溶液反应,最多消耗240g溴 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com