
 2NH3(g)����H����92.4 kJ��mol��1��
2NH3(g)����H����92.4 kJ��mol��1��| ������� | ��ʼʱ���������ʵ���/mol | ƽ��ʱ��Ӧ�е������仯 | ||
| N2 | H2 | NH3 | ||
| �� | 1 | 3 | 0 | �ų�����a kJ |
| �� | 2 | 3 | 0 | �ų�����b kJ |
| �� | 2 | 6 | 0 | �ų�����c kJ |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 SiO2(s)��4HF(g)����H����148.9 kJ��mol��1��
SiO2(s)��4HF(g)����H����148.9 kJ��mol��1��| ��Ӧʱ��/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g),��Ӧ�ﵽƽ��ʱ,�����������A��B�����ʵ���֮����C�����ʵ������,����ʱA��ת����Ϊ(����)��
2C(g),��Ӧ�ﵽƽ��ʱ,�����������A��B�����ʵ���֮����C�����ʵ������,����ʱA��ת����Ϊ(����)��| A��40% | B��50% | C��60% | D��70% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2HBr(g)����H<0�����¶ȷֱ�ΪT1��T2��ƽ��ʱ��H2�����������Br2(g)�����ʵ����ı仯��ϵ��ͼ��ʾ������˵������ȷ���� (����)
2HBr(g)����H<0�����¶ȷֱ�ΪT1��T2��ƽ��ʱ��H2�����������Br2(g)�����ʵ����ı仯��ϵ��ͼ��ʾ������˵������ȷ���� (����)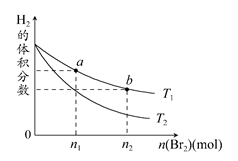
| A����ͼ��֪��T1>T2 |
| B��a��b����ķ�Ӧ���ʣ�b>a |
| C��Ϊ�����Br2(g)��ת���ʣ��ɲ�ȡ��HBrҺ������ʱ���ߵķ��� |
| D��T1ʱ������Br2(g)���룬ƽ��ʱHBr����������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3(g)����H����92.2 kJ��mol��1���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2���ü����̿��ˮ������Ӧ�Ƶá�
2NH3(g)����H����92.2 kJ��mol��1���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2���ü����̿��ˮ������Ӧ�Ƶá�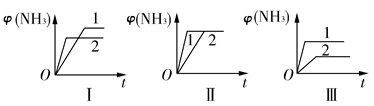
| A��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��p2>p1 |
| B��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��p1>p2 |
| C��ͼ������Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬��T1>T2 |
| D��ͼ�������ͬ��ͬѹ�²�ͬ�����Է�Ӧ��Ӱ�죬�Ҵ�������1>2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 3KCl+Fe��SCN��3���ڴ���Һ�������´�����ƽ�����Ƶ���
3KCl+Fe��SCN��3���ڴ���Һ�������´�����ƽ�����Ƶ���| A�����������Ȼ��ع��� | B�����������Ȼ������� |
| C������Fe��SCN��3��Ũ�� | D����ˮϡ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���ƽ������Ϊv(CH3OH)��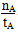 mol��L��1��min��1 mol��L��1��min��1 |
| B���÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ��С |
| C���÷�ӦΪ���ȷ�Ӧ |
D������A��ķ�Ӧ��ϵ��T1�䵽T2���ﵽƽ��ʱ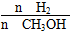 ���� ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO(g)��H2(g)�ﵽƽ��ı�־��(����)
CO(g)��H2(g)�ﵽƽ��ı�־��(����)| A������Ӧ���淴Ӧ���ʾ�Ϊ�� |
| B��v(H2O����)��v(CO����) |
| C����λʱ���ڷ�Ӧ����ٵķ������������������ӵķ����� |
| D��ѹǿ����ʱ��ı仯���仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
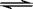 2NH3(g) ��H��0����ʼ �����mol N2����mol H2�� �ﵽƽ���N2��H2��NH3�����ʵ����ֱ�Ϊ1 mol��3 mol��10 mol���ش��������⣺
2NH3(g) ��H��0����ʼ �����mol N2����mol H2�� �ﵽƽ���N2��H2��NH3�����ʵ����ֱ�Ϊ1 mol��3 mol��10 mol���ش��������⣺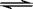 2NH3(g)����ʼ����1 mol N2��3 mol H2��16 mol NH3���������ݻ�ΪV L���ﵽƽ���N2��H2��NH3�����ʵ����ֱ�ΪAmol��Bmol��c mol����ʱ�������ݻ�Ϊ1.1V L���ش��������⣺
2NH3(g)����ʼ����1 mol N2��3 mol H2��16 mol NH3���������ݻ�ΪV L���ﵽƽ���N2��H2��NH3�����ʵ����ֱ�ΪAmol��Bmol��c mol����ʱ�������ݻ�Ϊ1.1V L���ش��������⣺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com