
(6分)下图表示Zn投入一定浓度一定体积的稀H2SO4溶液中后,反应时间与生成H2的体积的图象。(纵坐标为H2的生成速率)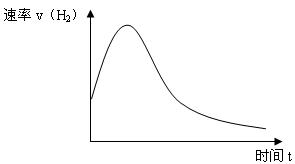
(1)反应前期速率加快的原因是: 。
(2)反应后期速率下降的原因是: 。
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是: 。
| A.蒸馏水 | B.氯化钠固体 | C.氯化钠溶液 | D.浓盐酸 |
科目:高中化学 来源: 题型:

各装置中试剂或物质分别是:
(A)2 mol·L-1 H2SO4 (B)Zn (C)2 mol·L-1 H2SO4+CuSO4 (D)Zn (E)CuSO4溶液 (F)NH3·H2O (G)30% H2O2 (H)H2S溶液 (I)NaOH溶液
已知:Cu2++4NH3·H2O====[Cu(NH3)4]2++4H2O,该反应的产物可作为H2O2分解的催化剂。请回答下列问题:
(1)进行实验前必须进行的操作是________________________________________________。
(2)B与D两容器中反应速率相比较:B_____D(填“>”“<”“=”)。其原因是_______________。
(3)H中的现象是_____________________________。
(4)I的作用是(用化学方程式表示)_______________________________________________。
(5)A和B之间的导管a的作用是______________________________________________。
(6)若去掉E装置,使D与F直接相连,并将F中液体换为酸性KMnO4溶液,实验时观察到H中产生与上述实验同样的现象。试写出此时G中发生反应的离子方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分)下图表示Zn投入一定浓度一定体积的稀H2SO4溶液中后,反应时间与生成H2的体积的图象。(纵坐标为H2的生成速率)
(1)反应前期速率加快的原因是: 。
(2)反应后期速率下降的原因是: 。
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是: 。
A.蒸馏水 B.氯化钠固体 C.氯化钠溶液 D.浓盐酸
查看答案和解析>>
科目:高中化学 来源:2011-2012学年辽宁省沈阳市高三模拟考试理科综合化学试卷(解析版) 题型:填空题
(17分)I.工业上有一种用CO2来生产甲醇燃料的方法:
将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。图中数据a(1,6)表示:在1 min时H2的物质的量是6 mol。

(1)a点正反应速率 (填“大于”“等于”或“小于”)逆反应速率。其化学平衡常数K=
(2)下列时间段平均反应速率最大的是 ,
A.O~1 min B.1~3 min C.3~8 min D.8~11 min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 ,体积不变再充入3molCO2和4 mol H2,H2O(g)的体积分数 (填“增大”“不变”或“减小”)
Ⅱ.某实验小组欲探究 反应速率与温度的关系,现有1mol/L的KI溶液、0.1mol/L的H2S04溶液、淀粉溶液,则实验时这几种试剂的加入顺序为:KI溶液、 、 ;
反应的方程式为
Ⅲ. 粗镍样品中含Fe、Zn、Ag、Cu等四种金属杂质,为获得高纯度的镍,某兴趣小组同学拟用铅蓄电池为电源,粗镍及石墨为电极,电解硝酸镍溶液对粗镍进行提纯。
(1)电解结束后,在阳极附近的沉淀物中,主要的金属单质为 (填化学式)。

(2) 若按上图所示连接对铅蓄电池进行充电。充电一段时间后。则在A电极上生成 (填化学式)。B电极上的电极反应式为 ;充电完毕。铅蓄电池的正极是 极(填“A”或“B”)。
(3)如用甲烷燃料电池为电源,在25℃、101 kPa时,若CH4在氧气中直接燃烧生成1 mol水蒸气放热401 kJ,而l g水蒸气转化成液态水放热2.445 kJ,则CH4的燃烧热为 (取整数)kJ·mol-。
查看答案和解析>>
科目:高中化学 来源:2010年广东省东莞市高一第二学期期末考试化学B卷 题型:填空题
(6分)下图表示Zn投入一定浓度一定体积的稀H2SO4溶液中后,反应时间与生成H2的体积的图象。(纵坐标为H2的生成速率)
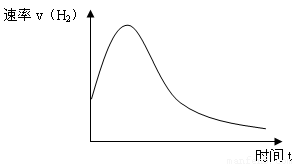
(1)反应前期速率加快的原因是: 。
(2)反应后期速率下降的原因是: 。
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是: 。
A.蒸馏水 B.氯化钠固体 C.氯化钠溶液 D.浓盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com