
分析 一个RxO72-离子反应时,反应就转移6个电子,说明x个R元素的化合价共降低了6价,根据得失电子守恒可以配平该反应,根据原子守恒可以得出x的值,氧化还原反应中,化合价降低元素所在的反应物是氧化剂,氧化剂对应产物是还原产物.
解答 解:(1)一个RxO72-离子反应时,反应就转移6个电子,说明x个R元素的化合价共降低了6价,亚铁离子到铁离子,化合价升高了1价,所以铁元素前面的系数都是6,根据氧元素守恒,所以水前边的系数是7,据氢元素守恒,所以氢离子前边系数是14,根据电荷守恒,R3+的系数是2,所以x=2,故答案为:2;
(2)根据(1)的分析,配平后的方程式为:RXO72-+6Fe2++14H+=2R3++6Fe3++7H2O,故答案为:1、6、14、2、6、7;
(3)化合价降低的元素是R,所以RXO72-是氧化剂,R3+是还原产物,故答案为:RXO72-、R3+;
(4)由RXO72-+6Fe2++14H+=2R3++6Fe3++7H2O,转移6个电子,则单线桥标出电子转移的方向和数目为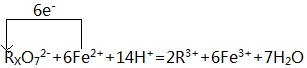 ,故答案为:
,故答案为: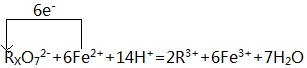 .
.
点评 本题考查学生氧化还原反应中的基本概念以及电子守恒来配平化学方程式的方法知识,注意知识的归纳和整理是关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.4 mol•(L•min)-1 | |
| B. | 2 min内,v正(B)和v逆(C)表示的反应速率的值都是逐渐减小的 | |
| C. | 2 min末的反应速率用B表示是0.3 mol•(L•min)-1 | |
| D. | 分别用B、C、D表示的反应速率其比值是3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将2.3 g Na投入到97.7 g水中充分反应,所得溶液的质量分数为4.0% | |
| B. | 相同质量的铝分别与足量的盐酸和NaOH溶液反应,生成气体物质的量之比为1:3 | |
| C. | 将CO2和H2O的混合气体a mol,与足量的Na2O2固体充分反应,生成的O2在标准状况下的体积为11.2a L | |
| D. | 120 mL含有0.20 mol碳酸钠的溶液与200 mL盐酸进行滴加反应,不管将前者滴入后者,还是后者滴入前者,滴加完全后,产生的气体在相同条件下体积不等,则盐酸的浓度可能为2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol的NaHSO4溶液中含0.2NA个阳离子 | |
| B. | 1L0.1mol/L的乙醇溶液中所含的分子总数为0.1NA个 | |
| C. | 在标准状况下,含NA个氦原子(He)的氦气所含的分子数是0.5NA个 | |
| D. | 1mol FeCl3跟沸水完全反应转化为氢氧化铁胶体,其中胶粒的数目一定少于NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b | B. | a=2b | C. | 2a=b | D. | 以上都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.02mol/L醋酸溶液与0.02mol/LKOH溶液等体积混合液 | |
| B. | 0.01mol/L醋酸溶液 | |
| C. | 0.03mol/L醋酸溶液与0.01mol/LKOH浓液等体积混合液 | |
| D. | pH=2的硝酸溶液与pH=12KOH溶液等体积混合液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com