
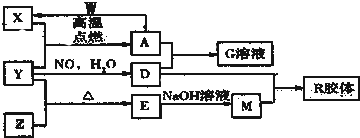
分析 图中X、Y、Z、W是地壳含量前四位(不按顺序)的元素组成的单质,其它为化合物,前四位元素为:氧、硅、铝、铁;A有磁性,A俗称磁性氧化铁,即为Fe3O4,根据框图中的转化关系,W为Al和Fe3O4发生铝热反应生成铁,可知X为铁、Y为O2、D为硝酸,G为四氧化三铁和硝酸发生氧化还原反应,反应生成硝酸铁溶液,四种元素中另一种元素Z为Si,则E为SiO2,M为硅酸钠,R为H2SiO3,据此答题.
解答 解:图中X、Y、Z、W是地壳含量前四位(不按顺序)的元素组成的单质,其它为化合物,前四位元素为,氧、硅、铝、铁;A有磁性,A俗称磁性氧化铁,即为Fe3O4,根据框图中的转化关系,W为Al和Fe3O4发生铝热反应生成铁,可知X为铁、Y为O2、D为硝酸,G为四氧化三铁和硝酸发生氧化还原反应,反应生成硝酸铁溶液,四种元素判断Z为Si,E为SiO2,M为硅酸钠,R为H2SiO3;
(1)依据分析可知,Y为氧元素,位于周期表中第二周期第ⅥA族,M为硅酸钠,化学式为Na2SiO3,
故答案为:第二周期第ⅥA族;Na2SiO3;
(2)R胶体中分散质直径大小范围为:1 nm~100 nm,可利用丁达尔效应区分胶体和溶液,
故答案为:1 nm~100 nm;丁达尔效应;
(3)A与 W反应是Al和Fe3O4发生铝热反应生成铁的反应,反应的化学方程式为:8Al+3Fe3O4 $\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3,
故答案为:8Al+3Fe3O4 $\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3;
(4)A为Fe3O4和足量D的稀溶液为稀硝酸发生氧化还原反应,反应生成G为硝酸铁,反应的离子方程式为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(5)检验G溶液为硝酸铁溶液,溶液中的金属阳离子为Fe3+,依据铁离子的检验方法设计实验方法为:取少量Fe(NO3)3溶液于一支试管中,加入几滴KSCN溶液,溶液呈血红色,证明含Fe3+,
故答案为:取少量Fe(NO3)3溶液于一支试管中,加入几滴KSCN溶液,溶液呈血红色,证明含Fe3+;
(6)工业由E制备Z的反应是利用二氧化硅制备硅单质,利用碳和二氧化硅高温加热反应生成,反应的方程式为:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
点评 本题考查无机物的推断,侧重物质转化和性质的考查,侧重铝热反应及硅及其化合物转化的考查,注意热化学反应方程式的书写方法,题目难度中等.


科目:高中化学 来源: 题型:填空题
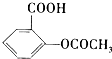 )是常用的解热镇痛药.它遇水会缓慢地水解生成水杨酸,则水杨酸的结构简式可表示为
)是常用的解热镇痛药.它遇水会缓慢地水解生成水杨酸,则水杨酸的结构简式可表示为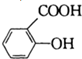 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{n(m-x+2)}{m}$ mol | B. | $\frac{n(m-x)}{m}$ mol | C. | $\frac{m-x+2}{m-n}$ mol | D. | $\frac{n(m-x-2)}{m}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
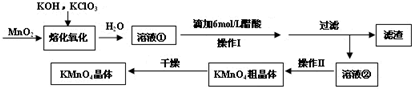
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
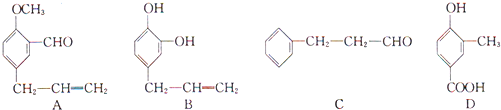
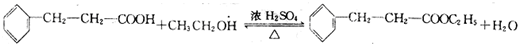 .
.
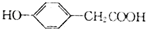 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
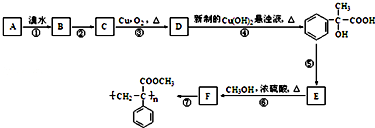
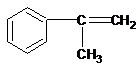 .
.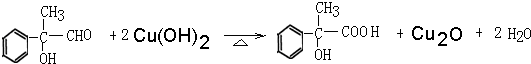 .
. .
.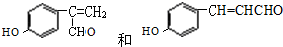 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量的KCl固体 | B. | 加入少量FeCl3固体 | ||
| C. | 降低Fe(SCN)3的浓度 | D. | 加水稀释 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加压 | B. | 减压 | C. | 升温 | D. | 减少E的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com