
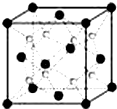
 A~G是前四周期原子序数依次增大的七种元素.A、C的价电子层中未成对电子数都是2;D+与C的简单离子具有相同离子结构;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G为周期表第11列元素.回答下列问题:
A~G是前四周期原子序数依次增大的七种元素.A、C的价电子层中未成对电子数都是2;D+与C的简单离子具有相同离子结构;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G为周期表第11列元素.回答下列问题: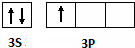 ,故答案为:
,故答案为: ;
;| 1 |
| 8 |
| 1 |
| 2 |
| 62 |
| NA |
| 3 |
| ||||
| 3 |
| ||
 ,F为Na+离子,A、B、C、D为O2-离子,令晶体中阴阳离子间最近的距离为r,即FA长=r,根据体积关系可知,AO长=4OF长,故FA长=3OF长,故AO长=r+
,F为Na+离子,A、B、C、D为O2-离子,令晶体中阴阳离子间最近的距离为r,即FA长=r,根据体积关系可知,AO长=4OF长,故FA长=3OF长,故AO长=r+| 1 |
| 3 |
| 4 |
| 3 |
| 2 |
| 3 |
| ||
| 2 |
| ||
| 3 |
a2-(
|
| ||
| 3 |
| ||
| 3 |
| 4 |
| 3 |
2
| ||
| 3 |
| ||
| 2 |
2
| ||
| 3 |
4
| ||
| 3 |
4
| ||
| 3 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| A、氢离子在负极得电子 |
| B、锌为负极,发生氧化反应 |
| C、铜为负极,铜片上有气泡产生 |
| D、电子从铜极流向锌极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知在高温、高压、催化剂作用下,1mol石墨转化为金刚石,吸收1.9kJ的热量.
已知在高温、高压、催化剂作用下,1mol石墨转化为金刚石,吸收1.9kJ的热量.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 |
| ①将少量的氯水滴入到适量NaBr溶液中,再滴入少量的CCl4溶液并用力振荡 | A.溶液分为上下两层,上层为无色,下层为橙红色 |
| ②将少量的溴水滴入到适量KI溶液中,再滴入少量的CCl4溶液并用力振荡 | B.溶液分为上下两层,上层为无色,下层为紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不慎碰倒酒精灯,洒出的酒精在桌上燃烧时,应立即用湿抹布扑盖 |
| B、将一氧化碳中毒者移到通风处去抢救 |
| C、眼睛里不慎溅进了药液,应立即用水冲洗,边洗边眨眼睛,不可用手揉眼睛 |
| D、不慎将浓硫酸溅到皮肤上,应立即用水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、Cu2+、Cl-、NO3- |
| B、K+、Na+、SO32-、S2- |
| C、K+、Na+、AlO2-、SO42- |
| D、Ba2+、Fe2+、NO3-、I- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com