
下列各项内容中,排列顺序正确的是
① 固体的热稳定性:Na2CO3>NaHCO3
② 相同物质的量浓度的下列溶液中NH4+ 的浓度:
(NH4)2SO4>(NH4)2CO3>NH4Cl
③ 微粒半径:K+>S2->F
④ 给出质子的能力:CH3COOH>C2H5OH>H2O
⑤ 氢化物的沸点:H2Se>H2S>H2O
A.①③ B.②④ C.①② D.③⑤
科目:高中化学 来源: 题型:
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
C.向反应后的溶液加入乙醇,溶液没有发生变化
D.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+
查看答案和解析>>
科目:高中化学 来源: 题型:
有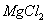 、
、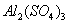 的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原溶液中
的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原溶液中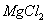 、
、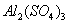 ,的物质的量浓度之比为 ( )
,的物质的量浓度之比为 ( )
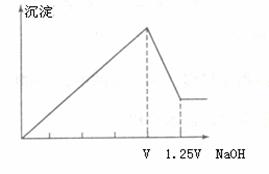
A.2:1 B.1:1 C 3:2 D. 2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),放入100mL某浓度的H2SO4溶液中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液,产生沉淀的质量m与加入NaOH溶液的体积的关系如图所示, 求:
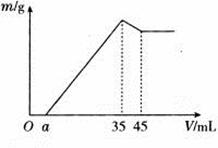
(1)原溶液中c(H2SO4)= mol/L。
(2)若a=2.3mL,计算各组分的质量:m(Al2O3)= g;m(SiO2)= g。
(3)计算a值的取值范围: < a < 。
查看答案和解析>>
科目:高中化学 来源: 题型:
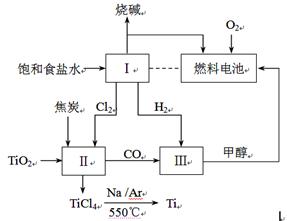 某小组根据工业生产原理设计如下转化关系,以获取烧碱和金属钛(Ti)。
某小组根据工业生产原理设计如下转化关系,以获取烧碱和金属钛(Ti)。
(1) 燃料电池中通入氧气的电极是 (填“正”或“负”)极,电极反应式是 ;用该电池电解饱和食盐水,若消耗32 g甲醇,理论上Ⅰ中可生成NaOH ________mol。
(2)如图所示,理论上加入Ⅱ中的TiO2和焦炭的物质的量之比是 ;由TiCl4得到金属Ti的化学方程式是 。
(3)根据Ⅲ中合成甲醇的反应,该小组保持温度不变,在两个相同的恒容密闭容器中进行实验,有关实验数据如下:
| 实验编号 | T/℃ | 平衡时压强 P/MPa | 起始用量/mol | 平衡时CO的转化率 | 放出热量/kJ | |
| n(H2) | n(CO) | |||||
| Ⅰ | 250 | 2 | 20 | 10 | 90% | A |
| Ⅱ | 250 | P1 | 40 | 20 | c | B |
① P1 4MPa(填“>”、“<”或“=”);
②实验Ⅰ条件下合成甲醇的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
250 ℃和1.01×105 Pa时,反应2N2O5(g)===4NO2(g)+O2(g) ΔH=+56.76 kJ/mol,自发进行的原因是 ( )
A.是吸热反应 B.是放热反应
C.是熵减反应 D.熵增效应大于能量效应
查看答案和解析>>
科目:高中化学 来源: 题型:
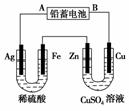
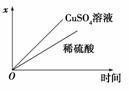
 已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
(1)A是铅蓄电池的________极,Zn电极反应式为__________________。
(2)Ag电极的电极反应式是________,该电极的电极产物共________g。
(3)Cu电极的电极反应式是________,CuSO4溶液的浓度________(填“减小”、“增大”或“不变”)
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示________。
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
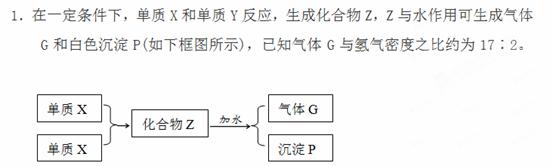 请填空:
请填空:
(1)组成单质X和Y的元素分别属第 族和第 族。
(2)化合物Z的化学式为 。
(3)每生成1 mol的气体G,同时应得到 mol的沉淀P。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com