
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
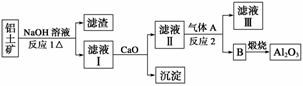
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:

回答下列问题:
(1)写出反应1的化学方程式_______________________________________________。
(2)滤液Ⅰ中加入CaO生成的沉淀是________,反应2的离子方程式为____________。
(3)E可作为建筑材料,化合物C是________,写出由D制备冰晶石的化学方程式________________________________________________________________________。
(4)电解法制铝的化学方程式是________,以石墨为电极,阳极产生的混合气体的成分是________。
答案 (1)2NaOH+SiO2===Na2SiO3+H2O、2NaOH+Al2O3===2NaAlO2+H2O
(2)CaSiO3 2AlO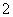 +CO2+3H2O===2Al(OH)3↓+CO
+CO2+3H2O===2Al(OH)3↓+CO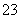 (或AlO
(或AlO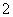 +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO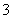 )
)
(3)浓H2SO4 12HF+3Na2CO3+2Al(OH)3===2Na3AlF6+3CO2+9H2O
(4)2Al2O3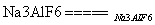 4Al+3O2↑ O2、CO2(CO)
4Al+3O2↑ O2、CO2(CO)
解析 结合Al2O3、SiO2与NaOH溶液反应后产物的性质来分析流程图一,根据萤石和纯碱为原料制取冰晶石来分析流程图二,充分利用质量守恒等来书写方程式。
(1)在加入NaOH溶液时,Al2O3和SiO2都能与NaOH反应,分别生成NaAlO2和Na2SiO3。(2)加入CaO后,SiO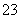 与Ca2+结合生成难溶物CaSiO3;滤液Ⅱ中主要含有AlO
与Ca2+结合生成难溶物CaSiO3;滤液Ⅱ中主要含有AlO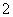 ,通入CO2后生成沉淀Al(OH)3,煅烧后生成Al2O3。(3)萤石能与浓硫酸反应生成CaSO4和HF气体;HF、Na2CO3、Al(OH)3三者没有发生氧化还原反应,根据质量守恒定律可写出化学方程式。(4)电解Al2O3制取金属铝,加入的冰晶石为助熔剂;阳极产生的O2能与石墨电极反应生成CO2(可能含有CO)。
,通入CO2后生成沉淀Al(OH)3,煅烧后生成Al2O3。(3)萤石能与浓硫酸反应生成CaSO4和HF气体;HF、Na2CO3、Al(OH)3三者没有发生氧化还原反应,根据质量守恒定律可写出化学方程式。(4)电解Al2O3制取金属铝,加入的冰晶石为助熔剂;阳极产生的O2能与石墨电极反应生成CO2(可能含有CO)。


科目:高中化学 来源: 题型:
下列叙述正确的是:
A.固体碘转化为紫红色气体,需吸收能量,因共价键被破坏
B.碳酸氢铵是离子化合物,其受热分解产生氨气不仅破坏离子键还破坏了共价键
C.金属和非金属所形成的化学键均为离子键
D.共价键只存在于共价化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
依据Mg、Al单质的性质,思考回答下列问题。
(1)铝的化学性质活泼,为什么日常生活中广泛使用的铝制品通常具有较好的抗腐蚀性能?
(2)Al既能溶于强酸,又能溶于强碱,所以说“Al既有金属性,又有非金属性”你认为这种说法是否恰当?为什么?
(3)铝与酸、碱反应的实质是什么?氧化剂是什么?
(4)镁在空气中充分燃烧,所得固体产物可能有哪些:________________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的无色溶液,不用其他试剂即可鉴别的是________。
①NaOH、AlCl3 ②NaHCO3、H2SO4 ③Na[Al(OH)4]、NaHSO4 ④Na2CO3、HCl ⑤Na2CO3、NaHCO3、Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用某种氧化铝矿石(含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
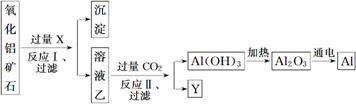
对上述流程中的判断正确的是 ( )
A.试剂X可以为氨水,沉淀中含有铁的化合物
B.CO2可以用H2SO4溶液或稀盐酸代替
C.反应Ⅱ中的反应为CO2+[Al(OH)4]-===Al(OH)3↓+HCO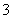
D.工业上还可采用Fe还原Al2O3的方法制Al,成本更低
查看答案和解析>>
科目:高中化学 来源: 题型:
有一块镁铝合金,其中镁与铝的质量比是8∶9。加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是
( )
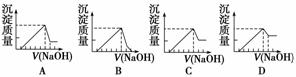
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。
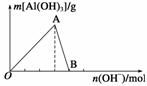
请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为__________。
(2)AB段曲线所表示的反应的离子方程式为___________________________________
________________________________________________________________________。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是________________________________________________________________________。
(4)向含有0.1 mol NH4Al(SO4)2溶液中逐滴加入5 mol·L-1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项所述的数字中与其他三项不相同的一项是 ( )
A.H2O分子的价电子总数
B.在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数
C.金属钠的晶胞中钠原子的配位数
D.氯化铯晶体中Cs+的配位数
查看答案和解析>>
科目:高中化学 来源: 题型:
植物及其废弃物可制成乙醇燃料,下列关于乙醇燃料的说法错误的是()
A.它是一种再生能源 B.乙醇易燃烧,污染小
C.乙醇只能在实验室内作燃料 D.粮食作物是制乙醇的重要原料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com