
【题目】右图为1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)能量变化的示意图,已知E1=xkJ/mol,E2=ykJ/mol,下列有关说法正确的是( )

A. 若在反应体系中加人催化剂,E1不变
B. 若在反应体系中加入催化剂,△H减小
C. 反应的活化能等于y kJmol-1
D. 1 mol SO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)的△H=(x-y) kJmol-1
科目:高中化学 来源: 题型:
【题目】A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 | 原子结构或性质 |
A | 原子最外层电子数是内层电子总数的1/5 |
B | 形成化合物种类最多的元素,其单质为固体 |
C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
D | 地壳中含量最多的元素 |
E | 与D同主族 |
F | 与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:
(1)A在元素周期表中的位置是_______________;A与E形成的化合物的电子式是 ________。
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是_________。
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是______。
(4) F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲和图乙表示的是短周期部分或全部元素的某种性质的递变规律,下列说法正确的是

A. 图甲横坐标为原子序数,纵坐标表示元素的最高正价
B. 图甲横坐标为核电荷数,纵坐标表示元素的原子半径(单位:pm)
C. 图乙横坐标为最高正价,纵坐标表示元素的原子半径(单位:pm)
D. 图乙横坐标为最外层电子数,纵坐标表示元素的原子半径(单位:pm)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L丁烷中C—C键数目为0.4NA
B. 0.1mol葡萄糖分子中官能团数目为0.6NA
C. 28g N2和NO组成的混合物中分子数目可能为0.9NA
D. 1L pH =13的NaOH溶液中,Na+数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国卫生部门制定的《关于宣传吸烟有毒与控制吸烟》的通知中规定:“中学生不准吸烟”。香烟燃烧产生的烟气中,有多种有害物质,其中尼古丁(C10H14N2)对人体危害最大,下列说法正确的是
A.尼古丁是由26个原子构成的物质
B.尼古丁中C、H、O 三种元素的质量比为10:14:2
C.尼古丁的相对分子质量是162g
D.尼古丁中氮元素的质量分数为17.3 %
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两化学活动小组对中学化学教材中“氨的催化氧化”进行了实验探究。
(1)甲小组设计了如图l所示的实验装置(固定装置已略去)。

①若装置A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管、橡胶塞和_____(填选项序号)。
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
②装置B的作用是______________;装置D的作用是____________。
③装置C中发生反应的化学方程式为_________________。
④若A、B中药品足量,则可以观察到装置F中的实验现象是_______________。
⑤该装置存在的主要缺陷是____________________。
(2)乙小组认为可将甲小组的装置中A、B部分换成如图2所示装置(其余部分相同)进行实验。
①烧瓶中加入的是过氧化钠固体,则分液漏斗中加入的最佳试剂是______,U型管中加入试剂是______。
②实验室制备氨气的化学反应方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ④ | |||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)元素⑧中质子数和中子数相等的同位素符号是:____________;
(2)④、⑤、⑥的离子半径由大到小的顺序为:________________;
(3)③的气态氢化物与其最高价氧化物对应水化物反应的化学方程式为:______________;
(4)④、⑤两种元素的原子按1:1组成的常见化合物,其阴、阳离子个数比为:__________;
(5)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知:液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,写出A与B反应的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶液与100mL0.55mol·L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃。已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J·℃-1,生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似为1g·mL-1。
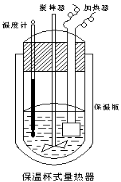
(1)试求CH3COOH的中和热△H = kJ/mol。
(2)CH3COOH的中和热的文献值为56.1KJ· mol-1,则请你分析在(1)中测得的实验值偏差可能的原因 。(答两条原因)
(3)实验中NaOH过量的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、某化学兴趣小组利用以下装置模拟合成氨并制备少量氨水
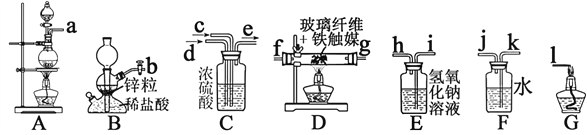
已知:加热(85℃)NH4Cl和NaNO2饱和溶液可以制取N2
B中仪器名称是___________________;
⑵为了完成实验,装置从左到右接口的连接顺序是_____![]() ______;
______;
⑶D中玻璃纤维的作用是_________________;
⑷小组中甲同学认为F装置不太合理,实验中会产生倒吸。乙同学认真分析后认为该装置无需改进,他的理由是________________________;
II、实验探究
⑸该小组同学利用制备的氨水再进行银镜反应实验。经查阅资料,配制的银氨溶液主要成分是[Ag(NH3)2]OH,小组同学对其组成进行了如下实验探究:
①在洁净的小试管中加入2mL 2%的AgNO3溶液,然后边振荡试管边滴加2%的稀氨水溶液,至最初产生的沉淀恰好溶解为止,制得银氨溶液。
②在制得的银氨溶液中加入无水乙醇,溶液变浑浊,过滤,用__________洗涤,得到白色固体;
③将该白色固体用适量蒸馏水溶解,得到无色溶液,用广范pH试纸检验溶液近似呈中性;向溶液中逐滴加入稀盐酸至不再产生沉淀,静置,取上层清液于另一支放有一小片铜的小试管中并微热,发现铜片的表面有气泡产生,遇到空气变成红棕色;另取少量上层清液加过量的NaOH溶液并加热,得到无色刺激性气体。由此确定通过上述方法制备的白色固体主要成分是___________________;
⑹请根据以上探究,设计实验来制备少量纯净的[Ag(NH3)2]OH溶液:取2mL 2%的AgNO3溶液于洁净的小试管中,_________________,即得到[Ag(NH3)2]OH溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com