
分析 2.4g镁的物质的量n=$\frac{2.4g}{24g/mol}$=0.1mol,500mL 1mol/L盐酸中HCl的物质的量n=CV=1mol/L×0.5L=0.5mol.根据化学方程式Mg+2HCl=ZnCl2+H2↑可知,0.1mol镁反应消耗0.2mol盐酸,故盐酸过量.
(1)由于盐酸过量,故根据镁的量来计算生成的氢气的量.设生成的氢气为xmol,则有Mg+2HCl=MgCl2+H2↑
1 1
0.1mol xmol
故有:$\frac{1}{0.1mol}=\frac{1}{xmol}$,据此解答;
(2)设反应中生成的镁离子的物质的量为ymol,消耗的氢离子的物质的量为zmol,则有:
Mg+2HCl=MgCl2+H2↑
1 2 1
0.1mol zmol ymol
则有:$\frac{1}{0.1mol}=\frac{2}{zmol}=\frac{1}{ymol}$,据此解答.
解答 解:2.4g镁的物质的量n=$\frac{2.4g}{24g/mol}$=0.1mol,500mL 1mol/L盐酸中HCl的物质的量n=CV=1mol/L×0.5L=0.5mol.根据化学方程式Mg+2HCl=ZnCl2+H2↑可知,0.1mol镁反应消耗0.2mol盐酸,故盐酸过量.
(1)由于盐酸过量,故根据镁的量来计算生成的氢气的量.设生成的氢气为xmol,则有Mg+2HCl=MgCl2+H2↑
1 1
0.1mol xmol
故有:$\frac{1}{0.1mol}=\frac{1}{xmol}$,解得x=0.1mol,
在标况下的体积V=nVm=0.1mol×22.4L/mol=2.24L
答:生成的氢气在标况下为2.24L.
(2)反应中生成的镁离子的物质的量为ymol,消耗的氢离子的物质的量为zmol,则有:
Mg+2HCl=MgCl2+H2↑
1 2 1
0.1mol zmol ymol
则有:$\frac{1}{0.1mol}=\frac{2}{zmol}=\frac{1}{ymol}$.
解得y=0.1mol,z=0.2mol
即溶液中镁离子的物质的量为0.1mol,而氢离子的物质的量n=0.5mol-0.2mol=0.3mol
故溶液中镁离子的物质的量浓度c=$\frac{0.1mol}{0.5L}$=0.2mol/L;
溶液中氢离子的物质的量浓度c=$\frac{0.3mol}{0.5L}$=0.6mol/L.
答:所得溶液中镁离子的浓度为0.2mol/L,氢离子浓度为0.6mol/L.
点评 本题考查了有关化学方程式的计算,难度不大,应注意根据化学方程式计算是的原则是”上下一致,左右相当“.


科目:高中化学 来源: 题型:解答题

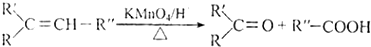
 .
. .
.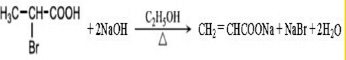 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
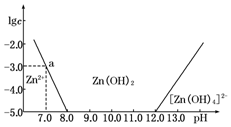
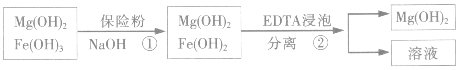
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
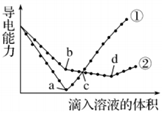
| A. | b点,水电离产生的c(H+)<10-7mol/L | B. | ①代表滴加H2SO4溶液的变化曲线 | ||
| C. | a、d两点对应的溶液均显中性 | D. | c点,两溶液中含有相同量的 OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙的化学式:CaClO2 | |
| B. | 作为相对原子质量标准的碳原子可表示为:126C | |
| C. | 钠原子的结构示意图: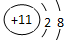 | |
| D. | 硫酸的电离方程式:H2SO4═H++SO42- |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
常温时0.05mol/L的Ba(OH)2溶液,pH为 ( )
A.12.7 B.12.0 C.13.0 D.13.7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com