
| A、电线电缆 | B、古铜钱 |
| C、流通硬币 | D、碳素钢 |
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
| A、应用环形玻璃搅拌棒轻轻搅动混合液 |
| B、实验中应使用相同浓度和体积的NaOH和HCl |
| C、实验中两个大小不同的烧杯间要填满碎纸条,目的是减少实验过程中热量的损失 |
| D、用相同体积的浓硫酸代替HCl溶液进行实验,测得中和热的数值比理论值偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
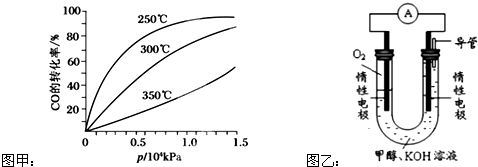
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、处于最低能量的原子叫做基态原子 |
| B、原子由基态变为激发态要产生发射光谱 |
| C、同一原子中,2p能级比3p能级的轨道数少 |
| D、3d轨道能量小于4s |
查看答案和解析>>
科目:高中化学 来源: 题型:
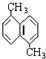 ③2,3,4-三甲基戊烷④间甲乙苯.
③2,3,4-三甲基戊烷④间甲乙苯.| A、①② | B、②③ | C、③④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L的CCl4中所含质子数为74 NA |
| B、2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA |
| C、12 g石墨晶体中含有的碳碳键数目为1.5 NA |
| D、分子数为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com