
| A. | 所得气体在标准状况下的体积 | B. | 所得气体的质量 | ||
| C. | 所得溶液的浓度 | D. | 原硫酸的浓度 |
分析 锌与浓硫酸反应生成硫酸锌和二氧化硫,随反应的进行,浓硫酸变稀硫酸,发生反应为:Zn+H2SO4═ZnSO4+H2↑,不管生成二氧化硫还是氢气,生成′1mol转移2mol的电子,也就是消耗1mol的锌生成1mol的气体,由此分析解答.
解答 解:锌与浓硫酸反应生成硫酸锌和二氧化硫,随反应的进行,浓硫酸变稀硫酸,发生反应为:Zn+H2SO4═ZnSO4+H2↑,不管生成二氧化硫还是氢气,生成′1mol转移2mol的电子,也就是消耗1mol的锌生成1mol的气体,
A、生成气体的物质的量知道,就可以求所得气体在标准状况下的体积,故A正确;
B、两者的物质的量分数不知,无法求气体的质量,故B错误;
C、所以得溶液的体积不知无法求浓度,故C错误;
D、生成二氧化硫的量不知,所以无法求原硫酸的浓度,故D错误;
故选A.
点评 本考点考查了根据化学方程式的计算,属于氧化还原和化学方程式的综合应用题,题型基础难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | Na2O2、MnO4-、H+ | Mn2+、O2、H2O、Na+ |
| ② | Na2O2、H2O | NaOH、O2 |
| ③ | Na2O2、FeSO4 | Na2FeO4 |
| A. | 三组中Na2O2均作氧化剂 | |
| B. | 第②组反应中生成1molO2,转移电子的物质的量为4mol | |
| C. | 第③组反应中产物还有Na2SO4 | |
| D. | 氧化性的强弱顺序为Na2O2>MnO4->FeO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钠水溶液具有强氧化性,故可用作消毒剂 | |
| B. | 氢氟酸能蚀刻玻璃,是利用氢氟酸的弱酸性 | |
| C. | 常温下,铝能被浓硫酸钝化,可用铝罐贮运浓硫酸 | |
| D. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O溶液的c(OH-)>NaOH溶液的c(OH-) | |
| B. | c(Na+)=c(NH4+) | |
| C. | 等体积的氢氧化钠和氨水溶液分别与足量盐酸完全反应,NaOH消耗的盐酸体积多 | |
| D. | 将pH值相等的氢氧化钠和氨水溶液加水稀释相同倍数,氨水溶液的pH大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100gKHCO3和CaCO3的混合物,含有的阳离子数目为NA | |
| B. | 常温常压下,1 mol甲醇完全燃烧生成CO2和H2O,转移的电子数目为6NA | |
| C. | 标准状况下,22.4L丙烷含有的共价键数目为10NA | |
| D. | 常温下,0.1L0.1mol/L的NH4Cl溶液中,NH4+的数目为0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①②⑤ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 如下图的转化关系中,已知A是由短周期元素组成的酸式盐.D、Y、H为气体,X为无色液体,G和K均是常见的强酸.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.
如下图的转化关系中,已知A是由短周期元素组成的酸式盐.D、Y、H为气体,X为无色液体,G和K均是常见的强酸.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:推断题
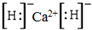 ;这种离子化合物可与水反应,化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑.
;这种离子化合物可与水反应,化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com