
(10分)在一个固定体积为2升的密闭容器中,充入2 mol A和1 mol B,发生如下反应:2A(g)+B(g)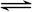 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
(1) 写出该反应平衡常数的表达式_____________________,2分钟内B 的平均反应速度为_____________________;
(2) 若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为______(填“吸热”或“放热”)反应;
(3) 若将容器体积缩小至1升,反应达到平衡时C的浓度为___________mol/L,平衡常数___________ (填“增大”、“减小”或“不变”)。
科目:高中化学 来源:2011-2012年海南省海南中学高二下学期期中考试理科化学试卷(带解析) 题型:填空题
(16分) 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)? ?2SO3(g) ΔH=-190kJ·mol-1
?2SO3(g) ΔH=-190kJ·mol-1
(1)该热化学反应方程式的意义是_______________________________________________
升高温度上述反应平衡常数____(填“变大”“变小”或“不变”)。
(2)下列描述中能说明上述反应已达平衡的是________。
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(3)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2)=__________mol·L-1·min-1;若继续通入0.20 mol SO2和0.10 mol O2,则平衡________________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(SO3)<________mol。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省厦门一中高二上学期期中考试化学试卷 题型:单选题
(10+6分)有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000 mL水,加入一定量的NaCl 固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm的细铁丝,将铁丝放入试管中,加入约 10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如右下图。过一会儿:
(1)观察到试管中的液面逐渐下降,这说明
在该条件下,铁丝发生了 腐蚀,
正极材料是 电极反应是
(2)再过一段时间发现液面停止下降,并且开始逐渐
上升,露在液面上的铁丝表面由原来的银白色变棕褐色,这说明在该条件下,铁丝发生了
腐蚀,正极的电极反应为
①总反应为: ;①反应的产物极易被进一步氧化,生成红褐色物质,②该反应的化学方程式为: 若铁锈的组成为:Fe2O3·xH2O ,试写出由②反应的产物在通常条件下生成铁锈的反应方程式:
③
附加题(6分)(3)已知原来铁丝质量为2 g,发生(1)情况时,依液面下降的高度折为标准状况下的体积是5.6mL,则此时,铁丝的质量变为 g ,随后液面开始上升,即发生(2)的变化,依最终液面上升的高度折算为标准状况下的体积比最开始刚倒扣于水槽中试管中溶液的体积多了1.12mL,通过计算,(2)的过程共消耗氧气 mL,若x值为2,那么铁丝的质量应为 g(以上计算有效数字保留至小数点后三位)
查看答案和解析>>
科目:高中化学 来源:2014届陕西省高一下学期期末考试化学试卷(解析版) 题型:填空题
(10分)在一个固定体积为2升的密闭容器中,充入2 mol A和1 mol B,发生如下反应:2A(g)+B(g) 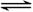 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
(1) 写出该反应平衡常数的表达式_____________________,2分钟内B 的平均反应速度为_____________________;
(2) 若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为______(填“吸热”或“放热”)反应;
(3) 若将容器体积缩小至1升,反应达到平衡时C的浓度为___________mol/L,平衡常数___________ (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2011-2012年海南省高二下学期期中考试理科化学试卷(解析版) 题型:填空题
(16分) 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)? ?2SO3(g) ΔH=-190kJ·mol-1
?2SO3(g) ΔH=-190kJ·mol-1
(1)该热化学反应方程式的意义是_______________________________________________
升高温度上述反应平衡常数____(填“变大”“变小”或“不变”)。
(2)下列描述中能说明上述反应已达平衡的是________。
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(3)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2)=__________mol·L-1·min-1;若继续通入0.20 mol SO2和0.10 mol O2,则平衡________________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(SO3)<________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com