


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:阅读理解
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:





| Cu |
| △ |
| Cu |
| △ |
| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源:2015届四川省雅安市高一下学期期末检测化学试卷(解析版) 题型:选择题
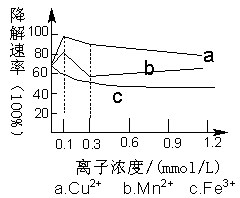
一定条件下,Cu2+、Mn2+、Fe3+的浓度对乙酸在光照下催化降解速率的影响如图所示。下列判断错误的是

A.该实验方案的缺陷之一是未做空白对照实验
B.Cu2+、Mn2+提高乙酸降解速率的最佳浓度为0.1 mmol·L-l
C.Fe3+不能提高乙酸降解速率
D.相同条件下,乙酸在Cu2+、Mn2+、Fe3+作用下的降解速率依次减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com