
分析 结合n=$\frac{m}{M}$、V=nVm及分子构成计算.
解答 解:(1)m g某气体,它由双原子分子构成,它的摩尔质量为M g•mol-1,含原子为$\frac{m}{M}$×2×NA=$\frac{2m{N}_{A}}{M}$,故答案为:$\frac{2m{N}_{A}}{M}$;
(2)气体在标准状况下的体积为$\frac{m}{M}$mol×22.4L/mol=$\frac{22.4m}{M}$L,故答案为:$\frac{22.4m}{M}$.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量、体积的关系为解答的关键,侧重分析与计算能力的考查,注意分子构成,题目难度不大.


科目:高中化学 来源: 题型:实验题
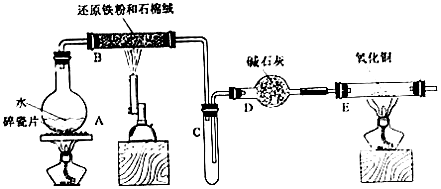
| 步骤 | 操作 | 甲组现象 | 乙组现象 | |
| 1 | 取黑色粉末加入稀盐酸 | 洛解,无气泡 | 溶解,无气泡 | |
| 2 | 取少骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 | |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 | |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
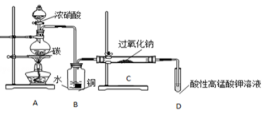 亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组进行下面实验探究,查阅资料知道:
亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组进行下面实验探究,查阅资料知道:| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al是地壳中含量最多的金属元素,但铝是使用较晚的金属 | |
| B. | Al是比较活泼的金属,在化学反应中容易失去电子,表现还原性 | |
| C. | Al箔在空气中受热可以熔化,且发生剧烈燃烧 | |
| D. | Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al并不滴落 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOH+OH-═HCOO-+H2O | B. | CO2+H2O?ΗCΟ3-+H+ | ||
| C. | CO32-+H2O?ΗCΟ3-+OH- | D. | HS-+H2O?S2-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com