
| 分子式 | 外观 | 热分解温度 | 熔点 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75~85℃ |
| 实验序号 | 1 | 2 | 3 | |
| KMnO4溶液的体积/mL | 滴定前读数 | 0.00 | 0.00 | 2.00 |
| 滴定后读数 | 19.98 | 20.00 | 22.02 | |
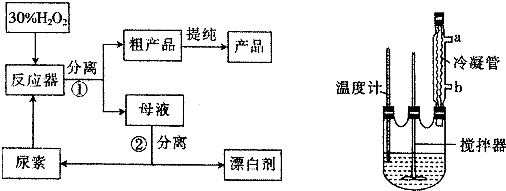
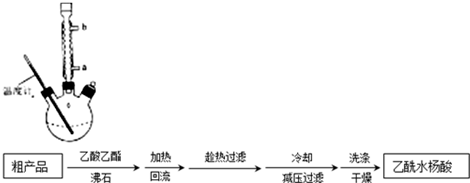
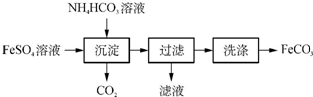
分析 合成过氧化尿素是利用过氧化氢和尿素化合反应生成过氧化尿素,反应的化学方程式为:CO(NH2)2+H2O2=CO(NH2)2•H2O2,经过滤得到CO(NH2)2•H2O2粗产品,母液经分离得到尿素和漂白剂,漂白剂主要含有过氧化氢,
(1)过滤用到的玻璃仪器有漏斗、烧杯和玻璃棒;
(2)过氧化氢和尿素化合反应生成过氧化尿素;
(3)冷凝水应该从下口流入,温度过高,产品易分解;
(4)过氧化氢与Fe、Al反应.
(5)①酸性KMnO4溶液有强氧化性和酸性,应盛放在酸式滴定管中;
②依据滴定过程误差分析依据,c标准×V标准=c待测×V待测,产生误差的原因是标准液消耗的多少分析判断;
③已知尿素与KMnO4溶液不反应,发生的反应为5H2O2+2KMnO4+3H2SO4=8H2O+2MnSO4+K2SO4+5O2↑,根据高锰酸钾的物质的量求出H2O2和CO(NH2)2•H2O2的物质的量,再求出质量和质量分数.
解答 解:(1)流程中操作①是过滤,用到的玻璃仪器有漏斗、烧杯和玻璃棒,
故答案为:烧杯;玻璃棒;
(2)过氧化氢和尿素化合反应生成过氧化尿素,反应的化学方程式为:CO(NH2)2+H2O2=CO(NH2)2•H2O2,
故答案为:CO(NH2)2+H2O2=CO(NH2)2•H2O2;
(3)冷凝水应该从下口流入,这样冷凝效果好,故冷凝水从b口流入;CO(NH2)2•H2O2在45℃时发生分解,所以不能用酒精灯直接加热,应该用水浴加热;温度过高,产品易分解,致使活性氧含量降低,
故答案为:b;温度过高,产品易分解,致使活性氧含量降低;
(4)过氧化氢与Fe、Al反应生成三价铁离子,三价铁离子会加速过氧化氢的分解,所以搅拌器不能用铁质、铝质材料的,
故答案为:铝、铁易被氧化.
(5)①KMnO4溶液具有强氧化性,能将碱式滴定管下端的橡胶管氧化,所以不能用碱式滴定管量取,可以用酸式滴定管量取,滴定终点的现象为:滴入最后一滴KMnO4溶液时,溶液显浅红色,且半分钟内不褪色;
故答案为:酸;滴入最后一滴KMnO4溶液时,溶液显浅红色,且半分钟内不褪色;
②若滴定前滴定管尖嘴处无气泡,滴定后有气泡,依据反应的电离关系可知,5×c标准×V标准=c待测×V待测×2,测得标准液体积偏小,结果偏低,
故答案为:偏低;
③已知尿素与KMnO4溶液不反应,发生的反应为5H2O2+2KMnO4+3H2SO4=8H2O+2MnSO4+K2SO4+5O2↑,三次平均用去的KMnO4溶液为20.00mL
5H2O2~~~~~2KMnO4
5 2
nmol 0.2000mol•L-1×0.020L
则n=0.01mol,所以CO(NH2)2•H2O2为0.01mol,其质量为0.01mol×94g/mol=0.94g
所以产品中CO(NH2)2•H2O2的质量分数为$\frac{0.94g}{12g×\frac{25mL}{250mL}}$×100%=78.3%;
故答案为:78.3%.
点评 本题考查了物质制备实验过程分析判断,装置图的理解应用,为高频考点,把握发生的化学反应及实验操作为解答的关键,侧重分析能力及实验能力的考查,注意信息与所学知识的结合,题目难度较大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
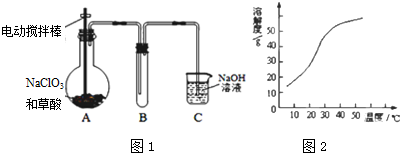
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
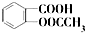 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
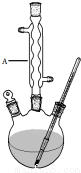 水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(结构简式为
水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(结构简式为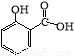 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
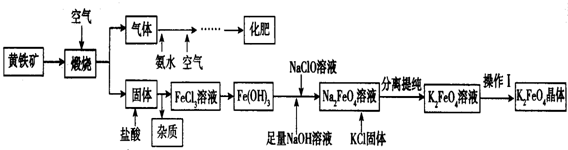
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 沸点/℃ | |
| 1-丁醇 | -89.53 | 117.25 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验操作步骤 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
| Ⅱ | 取少量实验步骤Ⅰ所得固体置于一洁净的试管中,用足量的稀硫酸溶解 |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示.
甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com