
 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”). .
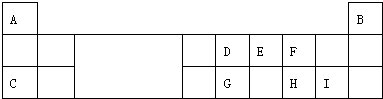
. 分析 由元素在周期表中位置,可知A为氢、B为He、C为Na、D为碳、E为氮、F为氧、G为Si、H为硫、I为Cl.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强;
(2)非金属性越强,对应氢化物越稳定;
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物为NH3,氨气溶于水后的溶液呈碱性;
(5)S2-阴离子的核外电子数与中子数相等,则中子数为18,质量数=质子数+中子数;
(6)CO2属于共价化合物,用电子式表示形成过程,左侧为原子电子式,右侧为相应物质电子式,中间用→连接.
解答 解:由元素在周期表中位置,可知A为氢、B为He、C为Na、D为碳、E为氮、F为氧、G为Si、H为硫、I为Cl.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故上述元素中Na的金属性最强,故答案为:钠;
(2)非金属性C>Si,非金属性越强,对应氢化物越稳定,故稳定性CH4>SiH4,故答案为:CH4;
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物为NH3,电子式为 ,氨气溶于水后的溶液呈碱性,故答案为:
,氨气溶于水后的溶液呈碱性,故答案为: ;碱;
;碱;
(5)S2-阴离子的核外电子数与中子数相等,则中子数为18,则质量数Z=16+18=34,故答案为:34;
(6)CO2属于共价化合物,用电子式表示形成过程为 ,
,
故答案为: .
.
点评 本题考查元素周期表与元素周期律应用,比较基础,注意理解掌握用电子式表示物质或化学键的形成.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 装置 | 目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉就会溶解 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| C. | 白纸上滴加浓硫酸后变黑体现了浓硫酸的吸水性 | |
| D. | HNO3→NO→NO2,以上各步变化均能通过一步实验完成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;试用电子式表示原子个数比为2:1的该化合物的形成过程
;试用电子式表示原子个数比为2:1的该化合物的形成过程 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com