
中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用题图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
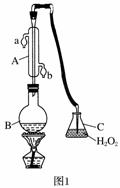

(1)仪器A的名称是______________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为________________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择题图2中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施________________________________________________________________________
________________________________________________________________________。
答案 (1)冷凝管(或冷凝器) b
(2)SO2+H2O2===H2SO4
(3)③ 酚酞 ④ (4)0.24
(5)原因:盐酸的挥发;改进措施:用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响
解析 (1)A仪器的名称为冷凝管或冷凝器;为使冷却效果好,应将冷却水从处于低处的b口通入。
(2)SO2具有强还原性,H2O2具有强氧化性,二者发生氧化还原反应:SO2+H2O2===H2SO4。
(3)NaOH盛装在碱式滴定管中,应将橡皮管向上弯曲排出气泡,故选③。滴定至终点时溶液的pH=8.8,在酚酞的变色范围内,故可选用酚酞作指示剂。液面在10 mL时滴定管中有刻度的液体为40 mL,因滴定管的下端有一段无刻度,故管内液体的体积大于40 mL。
(4)SO2与NaOH存在如下关系:
SO2 ~ H2SO4 ~ 2NaOH
64 g 2 mol
m(SO2) 0.090 0 mol·L-1×0.025 L
解得:m(SO2)= =0.072 g,故葡萄酒中SO2的含量为
=0.072 g,故葡萄酒中SO2的含量为 =0.24 g·L-1。
=0.24 g·L-1。
(5)盐酸为挥发性酸,挥发出的HCl消耗NaOH,使测量值偏大。可以用难挥发的稀硫酸代替盐酸进行该实验。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
(1)____HCl(浓)+____MnO2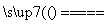 ____Cl2↑+____MnCl2+____H2O
____Cl2↑+____MnCl2+____H2O
(2)____Cu+____HNO3(稀)===____Cu(NO3)2+____NO↑+____H2O
(3)____KI+____KIO3+____H2SO4===____I2+____K2SO4+____H2O
(4)____MnO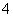 +____H++____Cl-===____Mn2++____Cl2↑+____H2O
+____H++____Cl-===____Mn2++____Cl2↑+____H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用KClO3和浓盐酸反应也可以制备氯气。某研究性学习小组利用如图所示装置在实验室中制取Cl2并探究其相关性质:
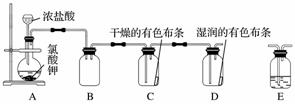
(1)装置A中存在一处错误,请改正这处错误:________________________。
(2)写出装置A中发生反应的化学方程式:________________________________________________________________________
________________________________________________________________________。
(3)为了除去氯气中的氯化氢,需要在装置A、B之间添加装置E,装置E中所盛装的试剂为________________。为了探究使有色布条褪色的是氯气还是氯气与水反应的生成物,需要在整套装置中添加装置E,其中加入浓硫酸,装置E在整套装置中的添加位置为________(填字母)。
a.A、B之间 b.B、C之间
c.C、D之间 d.D之后
(4)取下集气瓶B,将铁丝加热至红热状态,伸入集气瓶B中,可以观察到的现象是______________________,能检验该反应产物中铁元素价态的试剂是________(填字母)。
a.氯水 b.蒸馏水和铁粉
c.氢氧化钠溶液 d.KSCN溶液
(5)另外一个化学学习小组就环境保护方面指出了上述装置的缺陷,并给出了改进措施,该改进措施是________________________________________________________________________
__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
P原子的价电子排布为3s23p3,P与Cl形成的化合物有PCl3、PCl5,对此判断正确的是( )
①P原子最外层有三个不成对电子,故只能结合三个Cl原子形成PCl3 ②PCl3分子中的P—Cl键都是σ键 ③P原子最外层有三个不成对电子,但是能形成PCl5,说明传统的价键理论存在缺陷 ④PCl3分子中的P—Cl键都是π键
A.①② B.②③ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一份CuO和Cu2O的混合物,用H2还原法测定其中的CuO质量x g,实验中可以测定以下数据:①W:混合物的质量(g)、②W(H2O):生成水的质量(g)、③W(Cu):生成 Cu的质量(g)、④V(H2):标准状况下消耗H2的体积(L)。
(已知摩尔质量:Cu:64 g·mol-1、CuO:80 g·mol-1、Cu2O:144 g·mol-1、H2O:18 g·mol-1)
(1)为了计算x至少需要测定上述4个数据中的____个,这几个数据的组合共有________种。请将这些组合一一填入下列空格中。
说明:①选用W、W(H2O)、W(Cu)、V(H2)表示,不必列出具体算式。
②每个空格中填一种组合,有几种组合就填几种,不必填满。
(2)从上述组合中选出一个含W数据的求x的计算式:
________________________________________________________________________。
(3)以上数据组合中易于取得的一组是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解饱和Na2SO4溶液,一段时间后,析出w g Na2SO4·10 H2O晶体,阴极上放出a g气体,则饱和Na2SO4溶液的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在如图所示的装置中,若通直流电5 min时,铜电极质量增加2.16 g。试回答下列问题。
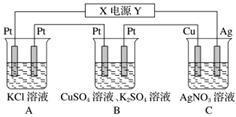
(1)电源中X电极为直流电源的________极。
(2)pH变化:A:________,B:________,C:________(填“增大”、“减小”或“不变”)。
(3)通电5 min时,B中共收集224 mL(标准状况下)气体,溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为________(设电解前后溶液体积无变化)。
(4)若A中KCl足量且溶液的体积也是200 mL,电解后,溶液的pH为__________(设电解前后溶液体积无变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com