
【题目】一定量的混合气体在密闭容器中发生反应 m A (g) + n B (g) ![]() p C (g)达到平衡后,温度不变,将容器体积缩小到原来的1/2,达到平衡时,C的浓度为原来的1.5倍,则下列说法正确的是
p C (g)达到平衡后,温度不变,将容器体积缩小到原来的1/2,达到平衡时,C的浓度为原来的1.5倍,则下列说法正确的是
A. m + n > pB. C的体积分数增加
C. 平衡向正反应方向移动D. A 的转化率降低
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料.请根据题意回答下列问题:
Ⅰ![]() 世界最早工业生产碳酸钠的方法是路布兰
世界最早工业生产碳酸钠的方法是路布兰![]() 法.其流程如下:
法.其流程如下:

![]() 流程I的另一产物是 ______ ,流程Ⅱ的反应分步进行:
流程I的另一产物是 ______ ,流程Ⅱ的反应分步进行:![]()

![]() ;
;
![]() 与石灰石发生复分解反应,总反应方程式可表示为 ______ .
与石灰石发生复分解反应,总反应方程式可表示为 ______ .
Ⅱ![]() 年,比利时人索尔维
年,比利时人索尔维![]()
![]() 用氨碱法生产碳酸钠.反应原理如下:
用氨碱法生产碳酸钠.反应原理如下:

![]() 时一些物质在水中的溶解度
时一些物质在水中的溶解度![]()
NaCl |
|
|
|
|
|
|
|
|
|
![]() 氨碱法生成纯碱的原料是 ______ ,可循环利用的物质有 ______ .
氨碱法生成纯碱的原料是 ______ ,可循环利用的物质有 ______ .
![]() 饱和NaCl溶液通
饱和NaCl溶液通![]() 和
和![]() 能生成
能生成![]() 的原因有: ______ .
的原因有: ______ .
Ⅲ![]() 我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.

![]() 生产中需向分离出
生产中需向分离出![]() 后所得的溶液中加入NaCl固体并通入
后所得的溶液中加入NaCl固体并通入![]() ,在 ______
,在 ______ ![]() 填温度范围
填温度范围![]() 下析出 ______
下析出 ______ ![]() 填化学式
填化学式![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.高温下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应
B.实验室用4mol SO2与2mol O2进行下列反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80%
2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80%
C.常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进
D.向3mL0.1mol/LAgNO3溶液中滴入5滴0.1mol/L NaCl溶液产生白色沉淀,再滴入KI稀溶液沉淀显黄色,则Ksp(AgI)<Ksp(AgCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如下图所示实验装置,分析实验原理,并判断下列说法和做法,其中不科学的是( )

A. 甲为小苏打,乙为纯碱
B. 要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C. 加热不久就能看到A烧杯的澄清石灰水变浑浊
D. 整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如下图所示是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法不正确的是

A. 简单离子半径:②>⑧>⑨
B. 简单氢化物的稳定性:⑤>⑧
C. 最高价氧化物对应的水化物的酸性:⑨>⑧>⑦
D. ①与⑤可形成既含极性键又含非极性键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2和N2O4可以相互转化:2NO2(g)![]() N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。
N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。

(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是___;a、b、c、d四个点中,表示化学反应处于平衡状态的点是___。
(2)前10min内用NO2表示的化学反应速率v(NO2)=___mol·L-1·min-1。
(3)①据图分析,在25min时采取的措施是___(填序号)。
A.加入催化剂 B.缩小容器体积
C.加入一定量的NO2 D.加入一定量的N2O4
②若在35 min时,保持温度不变,快速缩小容器的体积至1L,气体的颜色变化过程是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2 L的密团容器中进行某一反应,容器内M、N两种气体的物质的量随时间的变化曲线如图所示。据图可知

A. 该反应的化学方程式为N(g) ![]() 2M(g) B. t1~t2时间内,v(M)=(1/t2-t1) mol·L-1·min-1
2M(g) B. t1~t2时间内,v(M)=(1/t2-t1) mol·L-1·min-1
C. t2时,正逆反应速率相等,反应达平衡状态 D. 平衡时,物质N的转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用催化技术可将汽车尾气中的NO和CO转变成![]() 和
和![]() ,化学方程式如下:
,化学方程式如下:![]() 某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:下列说法中,不正确的是
某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:下列说法中,不正确的是
时间 | 0 | 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A.2s内的平均反应速率![]()
B.在该温度下,反应的平衡常数![]()
C.若将NO和CO的起始投料量均加倍,则平衡时NO转化率小于![]()
D.使用催化剂可以提高单位时间CO和NO的处理量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠用于制造陶瓷电容器的基体、颜料和催化剂。工业上以锡碲渣(主要含Na2SnO3和Na2TeO3)为原料,制备锡酸钠的工艺流程图如下,请回答下列问题:
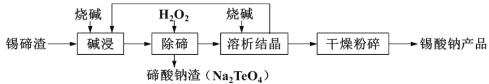
已知:锡酸钠(Na2SnO3)和亚碲酸钠(Na2TeO3)均易溶于碱。
(1)“碱浸”过程中,锡碲浸出率与溶液中游离碱质量浓度关系如图所示,则最理想的质量浓度为__________,理由是______________。

(2)如图反映的是“除碲”过程中反应温度对碲脱除率的影响关系,70℃后随温度升高碲脱除率下降的原因可能是______________。

(3)“除碲”反应的离子方程式为_________________。
(4)从“溶析结晶”回到“碱浸”的物质除烧碱外,主要还有_____________(写化学式)。
(5)“溶析结晶”母液中还含有少量SbO43-,可用锡片将Sb置换出来,锡转化成最高价含氧酸盐,写出反应的离子方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com