
【题目】茶叶中的茶多酚是一种天然抗氧化剂(其抗氧化能力是VC的5~10倍),它易溶于水、乙醇、乙酸乙酯,难溶于氯仿。在酸性介质中,茶多酚能将Fe3+还原为Fe2+,Fe2+与![]() 生成的深蓝色配位化合物
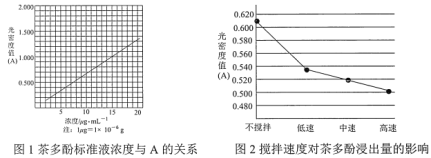
生成的深蓝色配位化合物![]() 对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图1所示:
对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图1所示:
某实验小组设计如下实验流程从茶叶中提取茶多酚:
请回答下列问题:
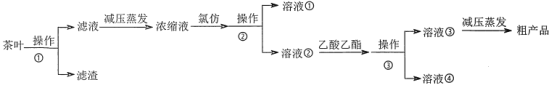
(1)操作①用水浸取茶多酚时,实验小组发现搅拌速度对茶多酚浸出量的影响如图2所示,原因是____。若用乙醇浸取茶多酚操作如下:称取10g茶叶末,用滤纸包好,装入恒压滴液漏斗中,圆底烧瓶内加沸石和适量乙醇,如图3安装后,通冷凝水,加热套加热,当乙醇被加热沸腾后,控制加热套温度在90℃。为使恒压漏斗内液面高出茶叶包约0.5cm,并保持约1h,可行的操作方法是____。
(2)减压蒸发相对于一般蒸发的优点是____。氯仿的作用是____。
(3)下列有关实验基本操作不正确的是___。
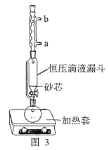
A. 图3中冷凝水流向为a进b出
B. 分液漏斗使用前须检验是否漏水并洗净备用
C. 操作①过滤时,可用玻璃棒适当搅拌以加快分离速度
D. 萃取过程中,经振摇并放气后,将分液漏斗置于铁圈上立即分液
(4)下列关于振摇操作的示意图,正确的是____。
A. 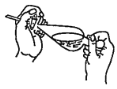 B.
B. 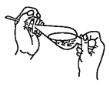 C.
C. 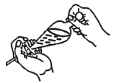 D.
D. 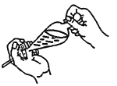
(5)称取1.25g粗产品,用蒸馏水溶解并定容至1000mL,移取该溶液1.00mL,加过量Fe3+和![]() 酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值A=0.800,则产品的纯度是____(以质量分数表示)。
酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值A=0.800,则产品的纯度是____(以质量分数表示)。
【答案】茶多酚易被氧气氧化,搅拌速度越快,茶多酚氧化速度越快,浸出率越低 关闭活塞,当漏斗内液面高出茶叶包约0.5cm时,调节活塞使乙醇冷凝速度与漏斗放液速度一致 降低蒸发温度防止产物氧化或分解 萃取(或除杂) CD A 96%
【解析】
根据流程,将茶叶处理用水溶解过滤除去不溶的滤渣,滤液含有茶多酚,浓缩后加入氯仿,茶多酚难溶于氯仿,分液,将含有茶多酚的溶液②与氯仿溶解其它杂质的溶液①分离,用乙酸乙酯萃取溶液②中的茶多酚,分液得到溶液③含有茶多酚,减压蒸发除去乙酸乙酯得到粗产品茶多酚;
(1)根据茶多酚的还原性分析;使恒压漏斗内液面高出茶叶包约0.5cm,并保持约1h,方法为关闭活塞,当漏斗内液面高出茶叶包约0.5cm时,调节活塞使乙醇冷凝速度与漏斗放液速度一致;
(2)减压蒸发可以降低蒸发温度,结合物质的氧化和分解可得;茶多酚难溶于氯仿,可用氯仿萃取杂质与茶多酚分离;
(4)振摇操作用左手握住分液漏斗活塞,右手压住分液漏斗口部;
(5)溶液光密度值A=0.800,则茶多酚的浓度为12×10-6g/mL,此时溶液中茶多酚的质量为12×10-6g/mL×100mL=12×10-4g,产品中茶多酚的质量为12×10-4g×![]() =1.2g,据此可得。
=1.2g,据此可得。
(1)根据图1可知,茶多酚浓度越大A越大,由图2可知,搅拌速度越快,A越小,则茶多酚浓度越小,因为茶多酚易被氧气氧化,搅拌速度越快,茶多酚氧化速度越快,浸出率越低;用乙醇浸取茶多酚操作如下:称取10g茶叶末,用滤纸包好,装入恒压滴液漏斗中,圆底烧瓶内加沸石和适量乙醇,如图3安装后,通冷凝水,加热套加热,当乙醇被加热沸腾后,控制加热套温度在90℃.为使恒压漏斗内液面高出茶叶包约0.5cm,并保持约1h,可行的操作方法是关闭活塞,当漏斗内液面高出茶叶包约0.5cm时,调节活塞使乙醇冷凝速度与漏斗放液速度一致;
(2)减压蒸发可以降低蒸发温度防止产物氧化或分解;根据流程氯仿的作用是萃取(或除杂);
(3)A.冷凝管通水方向为下进上出,图4中冷凝水流向为a进b出,故A正确;
B.带活塞的仪器使用前均需检验是否漏液,分液漏斗使用前须检验是否漏水并洗净备用,故B正确;
C.过滤时,为防止戳破滤纸,不可用玻璃棒搅拌,故C错误;
D.萃取过程中,经振摇并放气后,将分液漏斗置于铁圈上静置后分液,故D错误;
故答案为:CD;
(4)振摇操作用左手握住分液漏斗活塞,右手压住分液漏斗口部,把分液漏斗倒转过来振荡,使两种液体充分接触,选项A正确,故答案为A;
(5)溶液光密度值A=0.800,则茶多酚的浓度为12×10-6g/mL,此时溶液中茶多酚的质量为12×10-6g/mL×100mL=12×10-4g,产品中茶多酚的质量为12×10-4g×![]() =1.2g,故产品的纯度为
=1.2g,故产品的纯度为![]() ×100%=96%。
×100%=96%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】固体硝酸盐受热易分解且产物较复杂。已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应的化学方程式如下:
Ⅰ:2KNO3 ![]() 2KNO2+O2↑
2KNO2+O2↑
Ⅱ:2Cu(NO3)2 ![]() 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
Ⅲ:2AgNO3![]() 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
某固体可能由KNO3、Cu(NO3)2、AgNO3三种硝酸盐中的一种或几种组成。取适量该固体充分加热,得到一定量气体,该气体经水充分吸收后,剩余气体的体积在同温、同压下为吸收前的![]() (忽略氧气在水中的溶解)
(忽略氧气在水中的溶解)
(1)若该固体只由一种盐组成,则该盐为___________________,
(2)若该固体是混合物,则该混合物的可能组成为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水作为还原剂的是( )
A.2Na2O2+2H2O═4NaOH+O2↑B.3NO2+H2O═2HNO3+NO
C.2F2+2H2O═4HF+O2D.3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖在不同条件下可以被氧化成不同物质。请结合题意回答问题:
已知RCOOH+CH2=CH2+![]() O2
O2![]() RCOOCH=CH2+H2O
RCOOCH=CH2+H2O
(1)葡萄糖在酒化酶作用下生成有机物A,A、B、C、D、E间的转化关系如图所示:

①B是石油化学工业最重要的基础原料,写出A![]() B的化学方程式: __________________;
B的化学方程式: __________________;
②D的结构简式为__________________;
(2)葡萄糖在一定条件下还可被氧化为X和Y(Y和A的相对分子质量相同)。X可催化氧化成Y,也可与H2反应生成Z。X和Y的结构中有一种相同的官能团是_______,检验此官能团需用的试剂是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废铝屑中含有少量杂质Al2O3、SiO2。取一定量该废铝屑样品,加入2mol/L的硫酸溶液,消耗600mL硫酸溶液时样品不再溶解,收集到标准状况下的气体8.96 L,过滤。欲使滤液中的金属离子完全沉淀,至少应加入3mol/LNaOH溶液的体积是
A.300mLB.600mLC.800mLD.900mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学根据课本第50页科学探究实验,用三支试管、水槽、胶塞、导管、酒精喷灯及其它必要的仪器和物品,设计了以下实验装置,完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。
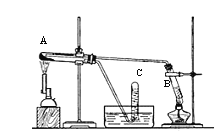
(1)写出该反应的化学方程式________。
(2)试管A中装的试剂是________ ;试管B中装的试剂是________。
(3)试管C中收集气体的方法叫作_________;收集的气体是(填化学式)_____。
(4)如果要在气体导出管口点燃该气体,则必须对该气体进行 _______。
(5)该同学欲确定反应后A试管中还原铁粉是否完全反应。设计了如下实验方案:第I步:待A试管冷却后,取少许其中的固体物质溶于稀硫酸,得溶液x;第II步:取少量溶液x滴加KSCN溶液,若溶液变红色则说明溶液x中含有_________。
①甲同学按照上述实验方案进行了实验,结果溶液未变红色,原因是(用离子方程式表示)____。
②乙同学按照上述实验方案进行了实验,结果溶液变红色。得出结论:A试管中还原铁粉反应完全。你觉得该结论是否合理?_______(填“合理”或“不合理”)请说明理由___________。(如果认为合理,此空不答。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究不含结晶水的白色正盐X(仅含三种元素)的组成和性质,设计并完成如下实验:

已知:M(X)=270g·mol-1,灼烧X并透过蓝色钴玻璃片可看到紫色火焰。请回答:
(1)无色液体B的化学式是____。
(2)固体X加热分解的化学方程式是____。
(3)将X加入MnSO4溶液中,溶液变成紫红色,该反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)宇航员常用过氧化钠作供氧剂,写出对应反应的化学方程__、__。
(2)新制氯水在阳光照射下容易分解产生无色气体,该反应的化学方程式是__。
工业上将氯气通入冷的消石灰制成漂白粉,写出该反应的化学方程式并用双线桥法表示电子转移的方向和数目的__。
(3)KAl(SO4)2·12H2O因其溶于水生成__(化学式)胶体可以吸附杂质,从而达到净水的目的。
(4)K2FeO4是一种重要的净水剂,可用下列方法制得:2Fe(OH)3+3Cl2+10KOH![]() 2K2FeO4+6KCl+8H2O。在该反应中,还原剂是__,当反应中有1molK2FeO4生成时,消耗的Cl2在标准状况下的体积为__L,转移电子的数目为__。
2K2FeO4+6KCl+8H2O。在该反应中,还原剂是__,当反应中有1molK2FeO4生成时,消耗的Cl2在标准状况下的体积为__L,转移电子的数目为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.在标准状况下,11.2 L氖气含有NA个氖原子
B.1 mol -CH3中含有电子数为10NA
C.![]() mol的HCl分子所含分子数为
mol的HCl分子所含分子数为![]() NA
NA
D.标准状况下22.4 L H2中含中子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com