
【题目】某工业废水中仅含下表离子中的5种:
阳离子 |
|
阴离子 |
|
某同学欲探究废水的组成,进行了如下实验:
Ⅰ![]() 取废水少许加入足量盐酸,无白色沉淀析出,但生成能使澄清石灰水变浑浊的无色无味气体
取废水少许加入足量盐酸,无白色沉淀析出,但生成能使澄清石灰水变浑浊的无色无味气体
Ⅱ![]() 向Ⅰ中所得的溶液中加入
向Ⅰ中所得的溶液中加入![]() 溶液,有白色沉淀生成.
溶液,有白色沉淀生成.
下列推断不正确的是![]()
A.溶液中一定含有的离子是![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
B.Ⅰ中加入盐酸生成无色气体的离子方程式是![]()
C.原溶液中的![]() 、
、![]() 、
、![]() 存在与否无法确定
存在与否无法确定
D.Ⅱ中产生白色沉淀的离子方程式是
【答案】C
【解析】
Ⅰ![]() 取废水少许加入足量盐酸,无白色沉淀析出,但生成能使澄清石灰水变浑浊的无色无味气体,气体为二氧化碳,则一定含
取废水少许加入足量盐酸,无白色沉淀析出,但生成能使澄清石灰水变浑浊的无色无味气体,气体为二氧化碳,则一定含![]() ,阴离子一定不含
,阴离子一定不含![]() ,阳离子一定不含
,阳离子一定不含![]() 、
、![]() 、
、![]() 、
、![]() ;
;
Ⅱ![]() 向Ⅰ中所得的溶液中加入
向Ⅰ中所得的溶液中加入![]() 溶液,有白色沉淀生成,因I中盐酸足量,白色沉淀可能为硫酸钡,则原溶液中一定含
溶液,有白色沉淀生成,因I中盐酸足量,白色沉淀可能为硫酸钡,则原溶液中一定含![]() ,以此来解答.
,以此来解答.
由上述分析可知,一定含![]() 、
、![]() ,由电荷守恒可知,阳离子一定含
,由电荷守恒可知,阳离子一定含![]() ,溶液中不含
,溶液中不含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,不能确定是否含
,不能确定是否含![]() 、
、![]() ,
,
A.因溶液含5种离子,则含有的离子是![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,选项A正确;
,选项A正确;
B.Ⅰ中加入盐酸生成无色气体为二氧化碳,离子方程式是![]() ,选项B正确;
,选项B正确;
C.由选项A可知,一定含![]() 、
、![]() 、
、![]() ,选项C错误;
,选项C错误;
D.Ⅱ中产生白色沉淀为硫酸钡,离子方程式是![]() ,选项D正确;
,选项D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】大庆市某中学化学实验小组在实验室鉴定某无色溶液.已知溶液中的溶质仅由![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种组成.取该溶液进行如下实验:
中的若干种组成.取该溶液进行如下实验:
![]() 取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液
取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液
![]() 在
在![]() 所得溶液中加入过量
所得溶液中加入过量![]() 溶液,有气体生成,同时产生白色沉淀甲;
溶液,有气体生成,同时产生白色沉淀甲;
![]() 在
在![]() 所得溶液中加入过量
所得溶液中加入过量![]() 溶液并加热也有气体生成,同时产生白色沉淀乙
溶液并加热也有气体生成,同时产生白色沉淀乙
则下列离子在原溶液中一定存在的有![]()
A.![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]() 、
、![]() 、
、
C.![]() 、
、![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验某溶液中是否含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,限用的试剂有:盐酸、硫酸、硝酸银溶液、硝酸钡溶液。设计如下实验步骤,并记录相关现象。下列叙述不正确的是
,限用的试剂有:盐酸、硫酸、硝酸银溶液、硝酸钡溶液。设计如下实验步骤,并记录相关现象。下列叙述不正确的是![]()
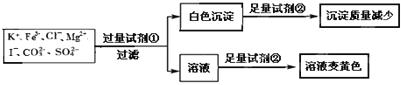
A.试剂![]() 为硝酸钡
为硝酸钡
B.试剂![]() 一定为盐酸
一定为盐酸
C.该溶液中一定有![]() 、
、![]() 、
、![]() 、
、![]()
D.通过在黄色溶液中加入硝酸银溶液可以检验原溶液中是否存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种离子.为了确定其成分,设计了如下实验;
中的几种离子.为了确定其成分,设计了如下实验;
![]() 取少量溶液于试管,滴加盐酸,观察到有大量气泡逸出,得到透明溶液;
取少量溶液于试管,滴加盐酸,观察到有大量气泡逸出,得到透明溶液;
![]() 在
在![]() 反应后的溶液中滴加硝酸银溶液,产生白色沉淀.
反应后的溶液中滴加硝酸银溶液,产生白色沉淀.
下列推断正确的是![]()
A.溶液中一定含![]() 、
、![]()
B.溶液中可能含![]() 、
、![]() 、
、
C.溶液中一定含![]() 、
、![]()
D.溶液中一定不含![]() 、
、![]() 、
、![]() 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子,该小组同学取100mL水样进行实验:向样品中先滴加氯化钡溶液,再滴加
中的若干种离子,该小组同学取100mL水样进行实验:向样品中先滴加氯化钡溶液,再滴加![]() 盐酸,实验过程中沉淀质量的变化如图所示.下列说法正确的是
盐酸,实验过程中沉淀质量的变化如图所示.下列说法正确的是![]()
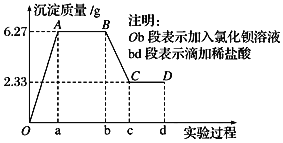
A.水样中一定不存在![]() 、
、![]() ,可能存在
,可能存在![]()
B.水样中一定存在![]() 、
、![]() 、
、![]()
C.BC段曲线所表示的离子方程式为![]()
D.水样中一定存在![]() ,且
,且![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列“实际应用”对应“化学知识原理”说法错误的是( )
选项 | 实际应用 | 化学知识原理 |
A | 泡沫灭火器中装有碳酸氢钠溶液 和硫酸铝溶液 | 碳酸氢钠溶液和硫酸铝溶液水解且相互促进 |
B | 工业上采用高压(20-50MPa)合成NH3 | 应用勒夏特列原理 |
C | 施加石膏降低盐碱地(含Na2CO3)的碱性 | CaCO3溶度积小于CaSO4 |
D | 选用金属锂做电池电极材料 | 锂轻且在空气中稳定 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液X,由![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子组成,取溶液进行如图连续实验
中的若干种离子组成,取溶液进行如图连续实验![]()
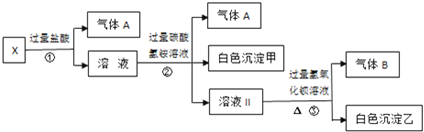
A.气体A是![]() ,白色沉淀甲是氢氧化铝
,白色沉淀甲是氢氧化铝
B.溶液中一定不含![]() 、
、![]() 、
、![]()
C.溶液Ⅱ是硫酸钠、碳酸氢铵、氯化钠的混合物
D.溶液中一定存在的离子有![]() 、
、![]() 、
、![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
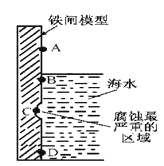
①该电化腐蚀称为__________________。
②图中A、B、C、D四个区域,生成铁锈最多的是_________(填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
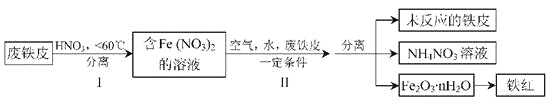
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为____________________。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为________________________。
③上述生产流程中,能体现“绿色化学”思想的是____________________(任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)=_____________。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2RO3是一种二元酸,常温下用1L1mol·L-1Na2RO3溶液吸收RO2气体,溶液的pH随RO2气体的物质的量的变化如图所示。下列说法正确的是
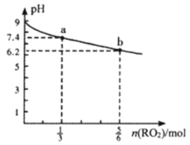
A.a点溶液中2c(Na+)=3c(RO32-)
B.向b点溶液中加水可使溶液的pH由6.2升高到7.4
C.常温下,NaHRO3溶液中c(HRO3-)>c(RO32-)>c(H2RO3)
D.当吸收RO2的溶液呈中性时,c(Na+)=c(RO32-)+c(HRO3-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com